Las regiones aceleradas humanas (HAR por sus siglas en inglés) son un conjunto de 49 segmentos del genoma humano que se conservan a lo largo de la evolución de los vertebrados, pero que son sorprendentemente diferentes en los humanos. Por otro lado, seguramente usted ha oído mencionar que los humanos y los chimpancés difieren en solo un uno por ciento de su ADN. Bueno, precisamente en las HAR de los humanos podemos encontrar una cantidad inesperada de estas diferencias. Los HAR fueron estables en los mamíferos durante milenios, pero cambiaron rápidamente en los primeros humanos. Los científicos se han preguntado durante mucho tiempo por qué estos fragmentos de ADN cambiaron tanto y cómo las variaciones distinguen a los humanos de otros primates. Un estimado colega nos comparte hoy el presente artículo donde investigadores de Gladstone Institutes analizan este fenómeno y llegan a interesantes conclusiones. El artículo en cuestion lo escribió Sarah Williams, se publicó el 13 de enero de 2023 en el boletín de noticias de Gladstone Institutes y lo tradujimos nosotros para este espacio. Veamos de qué se trata…
Los investigadores de los Gladstone Institutes han analizado miles de HAR humanos y de chimpancés y han descubierto que muchos de los cambios que se acumularon durante la evolución humana tenían efectos opuestos entre sí.

"Esto ayuda a responder una pregunta de larga data sobre por qué los HAR evolucionaron tan rápido después de haber estado congelados durante millones de años", dice la Dra. Katie Pollard, directora del Instituto Gladstone de ciencia de datos y biotecnología y autora principal del nuevo estudio publicado el 13 de enero de 2023 en Neuron. "Una variación inicial en un HAR podría haber aumentado demasiado su actividad, y luego tuvo que ser rechazada".
Los hallazgos, dice, tienen implicaciones para comprender la evolución humana. Además, debido a que ella y su equipo descubrieron que muchas HAR juegan un papel en el desarrollo del cerebro, el estudio sugiere que las variaciones en las HAR humanas podrían predisponer a las personas a enfermedades psiquiátricas.

"Estos resultados requirieron herramientas de aprendizaje automático de vanguardia para integrar docenas de nuevos conjuntos de datos generados por nuestro equipo, proporcionando una nueva perspectiva para examinar la evolución de las variantes de HAR", dice el Dr. Sean Whalen, primer autor del estudio y principal científico investigador del personal en el laboratorio de Pollard.
Habilitado por el aprendizaje automático
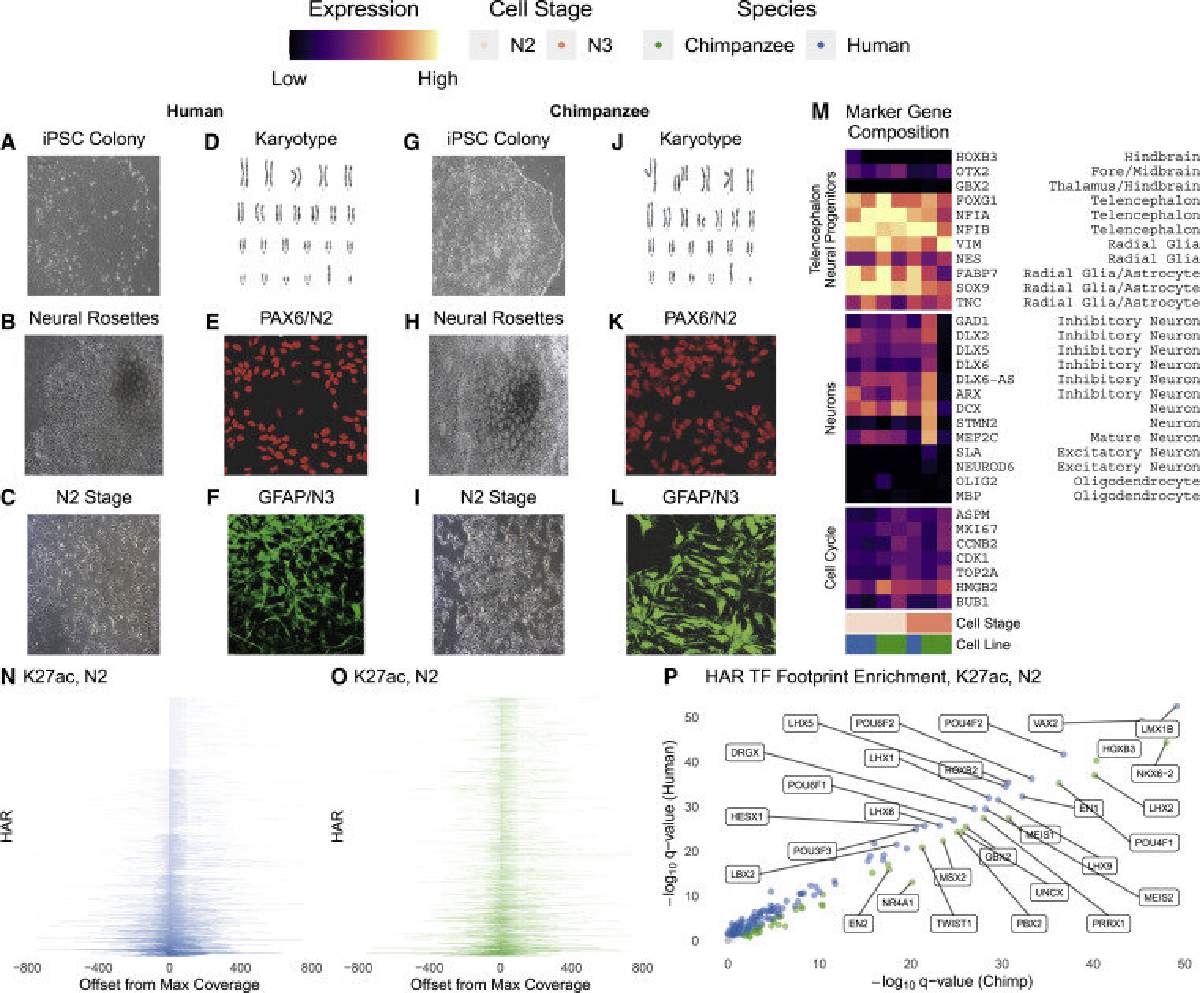
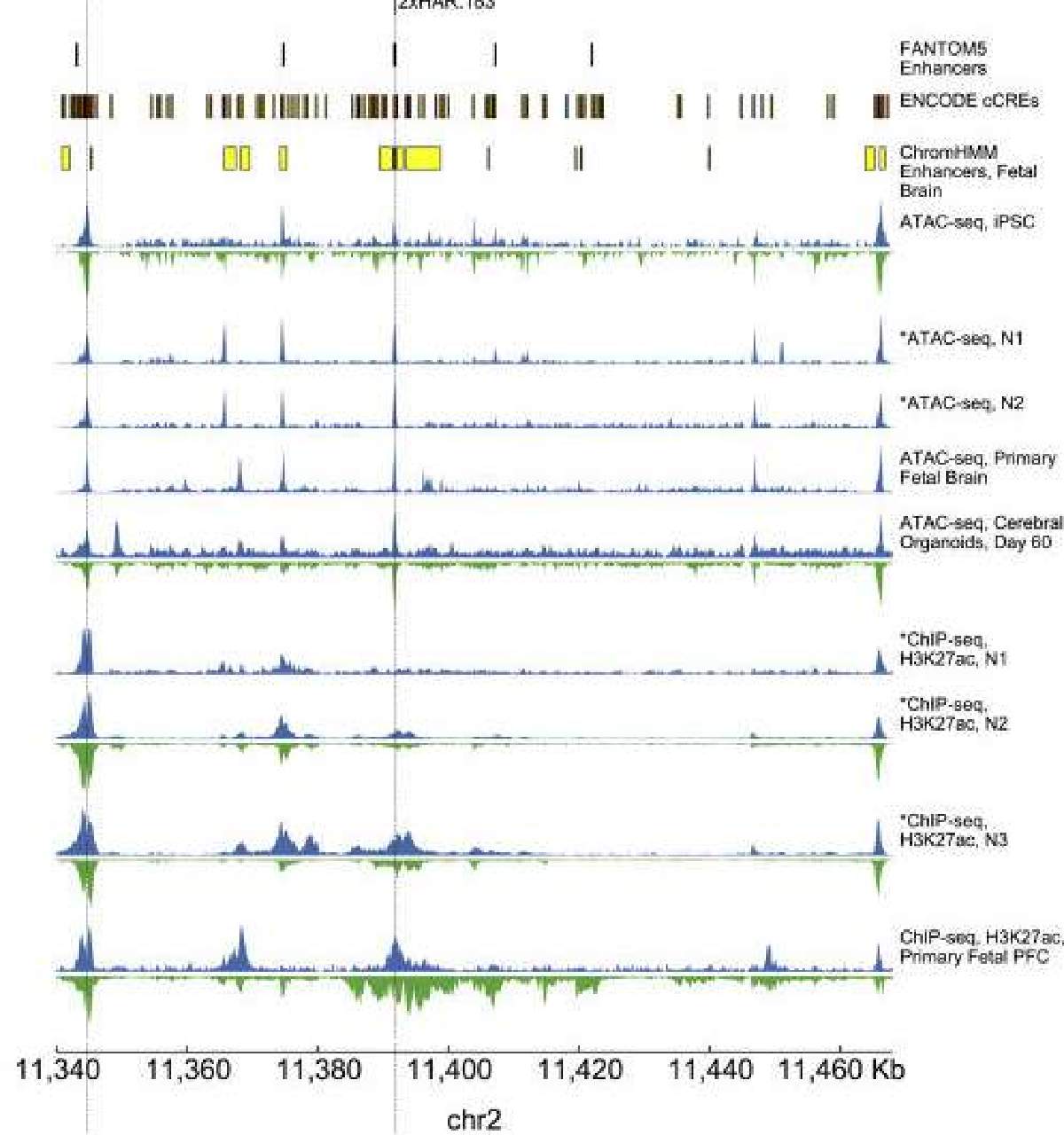
Pollard descubrió los HAR en 2006 al comparar los genomas humanos y de chimpancé. Si bien estos tramos de ADN son casi idénticos entre todos los humanos, difieren entre humanos y otros mamíferos. El laboratorio de Pollard continuó demostrando que la gran mayoría de los HAR no son genes, sino potenciadores: regiones reguladoras del genoma que controlan la actividad de los genes.
Más recientemente, el grupo de Pollard quería estudiar cómo los HAR humanos difieren de los HAR de chimpancé en su función potenciadora. En el pasado, esto habría requerido probar los HAR de uno en uno en ratones, usando un sistema que tiñe los tejidos cuando un HAR está activo.
En cambio, Whalen ingresó cientos de potenciadores cerebrales humanos conocidos y cientos de otras secuencias no potenciadoras en un programa de computadora para que pudiera identificar patrones que predijeran si un tramo dado de ADN era un potenciador. Luego usó el modelo para predecir que un tercio de los HAR controlan el desarrollo del cerebro.
"Básicamente, la computadora pudo aprender las firmas de los potenciadores del cerebro", dice Whalen.

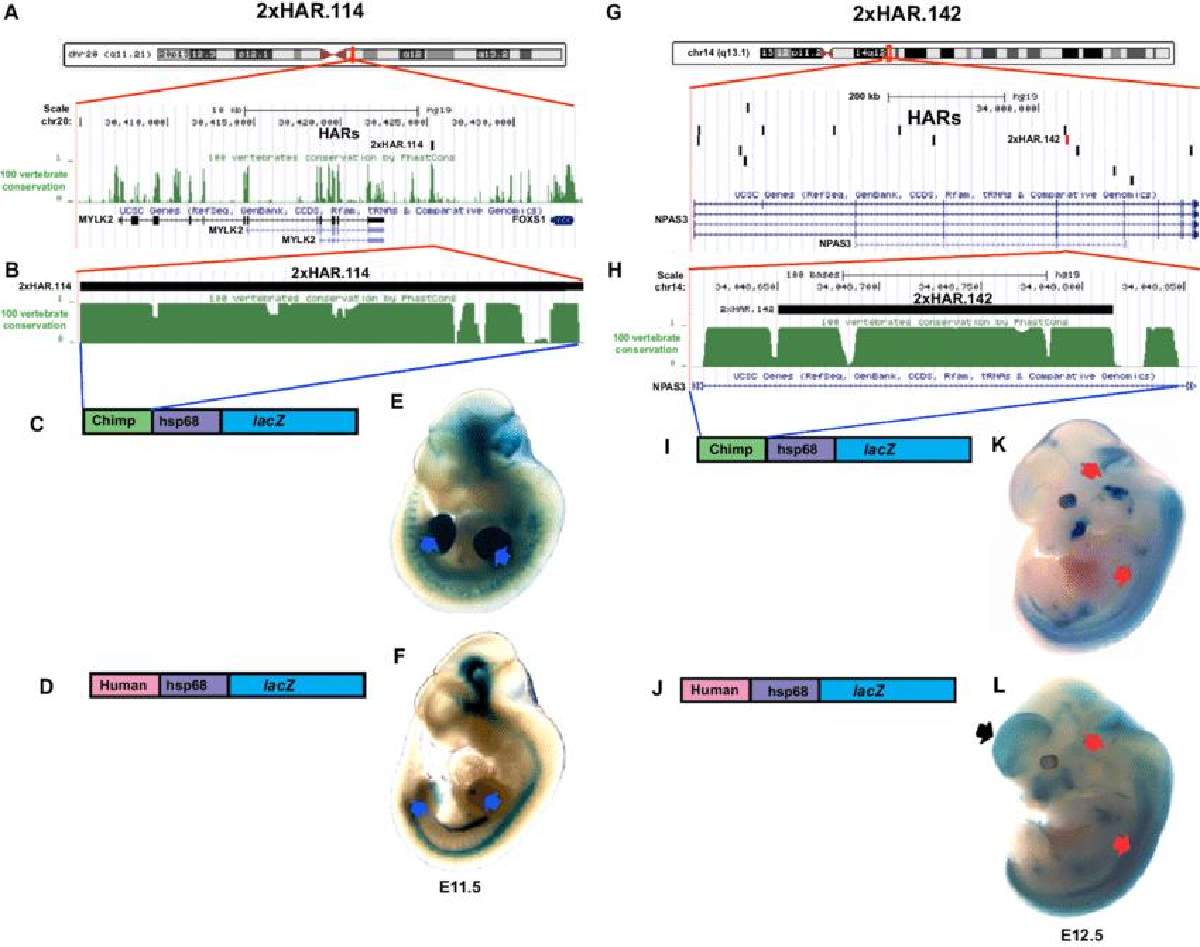
Sabiendo que cada HAR tiene múltiples diferencias entre los humanos y los chimpancés, Pollard y su equipo cuestionaron cómo las variantes individuales en un HAR impactaron en la fuerza de su potenciador. Por ejemplo, si ocho nucleótidos de ADN diferían entre un chimpancé y un humano HAR, ¿tenían los ocho el mismo efecto, haciendo que el potenciador fuera más fuerte o más débil?
"Durante mucho tiempo nos hemos preguntado si se requerían todas las variantes de los HAR para que funcionaran de manera diferente en los humanos, o si algunos cambios simplemente se hacían enganchándose con otros más importantes", dice Pollard, quien también es jefa de la división de bioinformática del Departamento de Epidemiología y Bioestadística de UC San Francisco (UCSF), así como un investigadora de Chan Zuckerberg Biohub.
Para probar esto, Whalen aplicó un segundo modelo de aprendizaje automático, que se diseñó originalmente para determinar si las diferencias de ADN de una persona a otra afectan la actividad del potenciador. La computadora predijo que el 43 por ciento de los HAR contienen dos o más variantes con grandes efectos opuestos: algunas variantes en un HAR dado lo convirtieron en un potenciador más fuerte, mientras que otros cambios hicieron que el HAR fuera un potenciador más débil.
Este resultado sorprendió al equipo, que esperaba que todos los cambios empujaran al potenciador en la misma dirección, o que algunos cambios "enganchados" no tuvieran ningún impacto en el potenciador.
Medición de la fuerza HAR
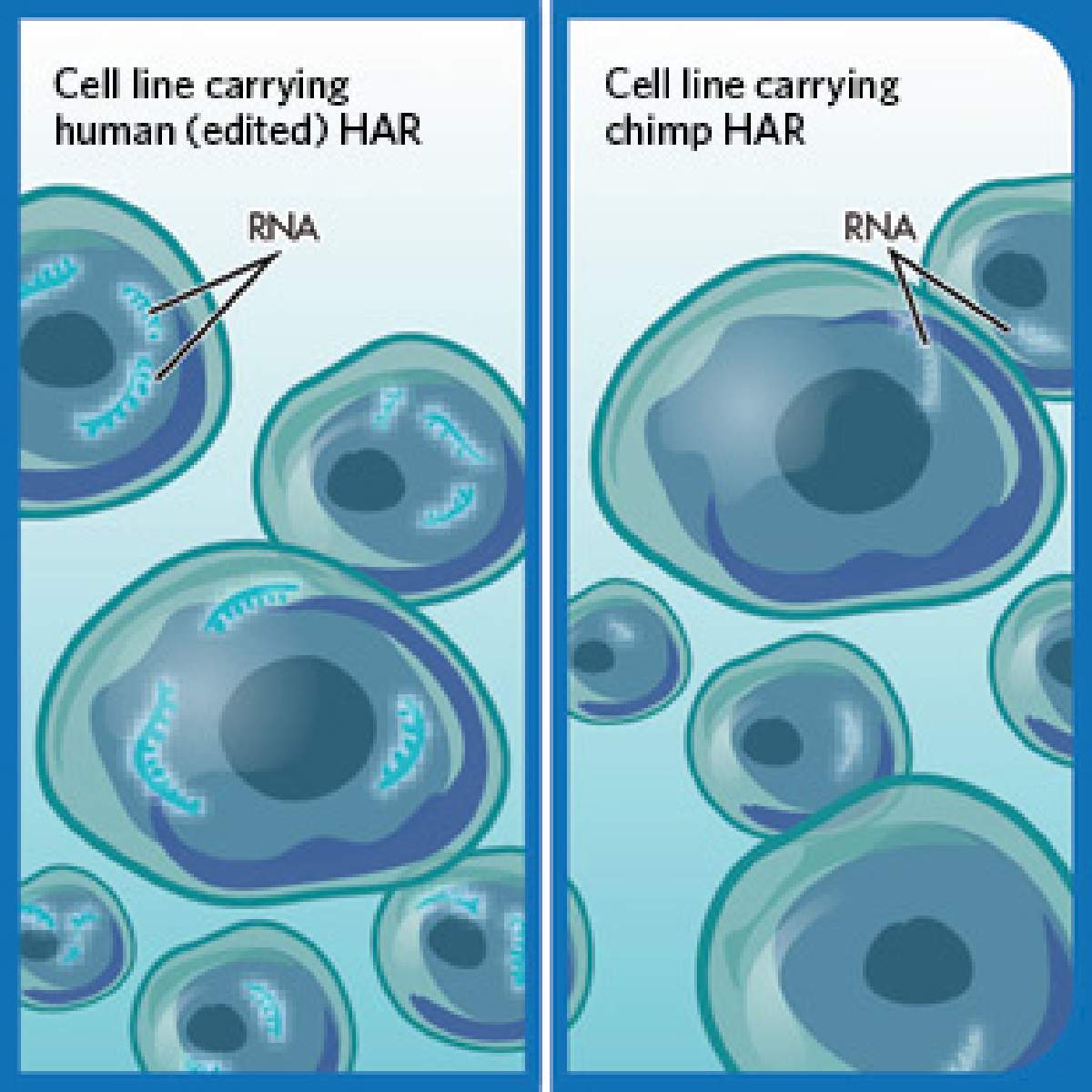
Para validar esta convincente predicción, Pollard colaboró con los laboratorios de los doctores Nadav Ahituv y Alex Pollen, en la UCSF. Los investigadores fusionaron cada HAR con un pequeño código de barras de ADN. Cada vez que un HAR estaba activo, mejorando la expresión de un gen, el código de barras se transcribía en un fragmento de ARN. Luego, los investigadores utilizaron la tecnología de secuenciación de ARN para analizar cuánto de ese código de barras estaba presente en cualquier célula, lo que indica qué tan activo había sido el HAR en esa célula.

"Este método es mucho más cuantitativo porque tenemos recuentos exactos de códigos de barras en lugar de imágenes de microscopía", dice Ahituv. "También es un rendimiento mucho mayor; podemos observar cientos de HAR en un solo experimento".
Cuando el grupo llevó a cabo sus experimentos de laboratorio en más de 700 HAR en precursores de células cerebrales humanas y de chimpancé, los datos coincidieron con lo que habían predicho los algoritmos de aprendizaje automático.
"Es posible que no hubiéramos descubierto variantes humanas de HAR con efectos opuestos si el modelo de aprendizaje automático no hubiera producido estas sorprendentes predicciones", dijo Pollard.
Implicaciones para entender la enfermedad psiquiátrica
La idea de que las variantes de HAR jugaron tira y afloja sobre los niveles de potenciadores encaja bien con una teoría que ya se ha propuesto sobre la evolución humana: que la cognición avanzada en nuestra especie también es lo que nos ha dado enfermedades psiquiátricas.
"Lo que indica este tipo de patrón es algo llamado evolución compensatoria", dice Pollard. "Se realizó un gran cambio en un potenciador, pero tal vez fue demasiado y provocó efectos secundarios dañinos, por lo que el cambio se redujo con el tiempo; es por eso que vemos efectos opuestos".
Si los cambios iniciales en HAR condujeron a una mayor cognición, tal vez los cambios compensatorios posteriores ayudaron a reducir el riesgo de enfermedades psiquiátricas, especula Pollard. Sus datos, agrega, no pueden probar o refutar directamente esa idea. Pero en el futuro, una mejor comprensión de cómo los HAR contribuyen a la enfermedad psiquiátrica no solo podría arrojar luz sobre la evolución, sino también sobre nuevos tratamientos para estas enfermedades.

"Nunca podremos retroceder el reloj y saber exactamente qué sucedió en la evolución", dice Pollard. "Pero podemos usar todas estas técnicas científicas para simular lo que podría haber sucedido e identificar qué cambios en el ADN tienen más probabilidades de explicar aspectos únicos del cerebro humano, incluida su propensión a las enfermedades psiquiátricas".
Fuentes:




