El Dr. Mondragón es Ingeniero Bioquímico por el Instituto Tecnológico de Zacatepec, con Maestría en Biotecnología por el Tecnológico de Monterrey Campus Monterrey y Doctorado en Ciencias (PhD) en Medicina Regenerativa por el University College London – Reino Unido. Su área de investigación está enfocada al uso de células troncales aplicadas a medicina regenerativa e ingeniería de tejidos, bioprocesos, generación de vasos sanguíneos, generación de CAR-T cells, estudio de cáncer entre otros. Actualmente es Director de CICATA Unidad Morelos del Instituto Politécnico Nacional e integrante de la Academia de Ciencias de Morelos.
Esta publicación fue revisada por el comité editorial de la Academia de Ciencias de Morelos.
¿Te imaginas vivir sin temor a perder la salud y las capacidades con el paso de los años? La salud es uno de nuestros bienes más preciados, y protegerla es esencial. Gracias a los avances en higiene, salud pública y medicina, nuestra expectativa de vida ha aumentado considerablemente. Sin embargo, también es más común enfrentarse a enfermedades degenerativas, especialmente a medida que envejecemos. Estas enfermedades, que afectan distintos órganos, pueden aparecer debido a factores internos o a exposiciones prolongadas a toxinas y dietas poco saludables. En particular, las enfermedades cardiovasculares representan un desafío importante.
Hasta hace poco, los tratamientos para estas enfermedades graves dependían de trasplantes de órganos, como el corazón, o de cirugías complejas. Sin embargo, los trasplantes tienen un gran obstáculo: el riesgo de rechazo por parte del sistema inmunológico. Aunque existen medicamentos para reducir este rechazo, al debilitar nuestras defensas, también nos hacen más vulnerables a infecciones causadas por bacterias y virus.
Pero, ¿y si pudiéramos reparar los tejidos dañados utilizando las propias células del paciente? Aunque suena como ciencia ficción, esta posibilidad está más cerca de lo que creemos y es objeto de intensa investigación. En nuestro cuerpo existen células especiales llamadas células troncales, que tienen la capacidad de transformarse en distintos tipos de células y regenerar tejidos dañados. Estas células podrían ser la clave para tratar diversas enfermedades sin los riesgos asociados a los trasplantes tradicionales.
En este artículo, exploraremos qué son las células troncales y cómo los científicos están desarrollando procesos avanzados para cultivarlas y dirigir su transformación, con el objetivo de llevar a cabo aplicaciones terapéuticas que podrían cambiar la medicina tal como la conocemos.
Células troncales y sus aplicaciones en ingeniería vascular
La principal característica de las células troncales (CT) es su potencial para diferenciarse y formar los diferentes tejidos y órganos especializados del cuerpo humano. Existen varios tipos de células troncales, y se clasifican por su potencial (totipotencial, pluripotencial, multipotencial y unipotencial) así como por su origen (embrionario o adulto) como se puede ver en la Figura 1. Las primeras CT durante el desarrollo embrionario, las llamamos totipotentes, debido a que son capaces de generar a un embrión incluyendo sus estructuras extraembrionarias (la placenta, saco vitelino y el cordón umbilical), éstas las encontramos únicamente en la mórula. Conforme avanza el desarrollo embrionario las células van perdiendo su potencialidad; al llegar al estadio de blastocisto, cada una de las células que forman parte de la masa celular interna, son incapaces de constituir estructuras extraembrionarias; sin embargo, conservan la capacidad de desarrollar cualquier célula de las 3 líneas germinales, a este tipo celular se le denomina células troncales pluripotentes. Continuando con la embriogénesis, en la gastrulación hay una migración y reorganización celular altamente coordinada, que, mediante invaginaciones, involuciones y delaminaciones, producen la delimitación y diferenciación de las 3 capas germinales: Ectodermo, Mesodermo y Endodermo. A partir de este punto podemos encontrar diferentes CT localizadas en tejidos específicos en el embrión. Estas células son nombradas CT multipotentes, ya que son capaces de generar diversos linajes celulares dentro de un mismo tejido, limitando su potencial de diferenciación. Por último, las CT unipotentes, son capaces de diferenciarse solamente hacia un único tipo de células, donde su función es mantener y regenerar al tejido en donde están ubicados. Un ejemplo claro de las CT unipotentes, no somáticas son las CT germinales, las cuales migran hacia las gónadas en el desarrollo embrionario (crestas genitales) y eventualmente dan lugar a los gametos (óvulos y espermatozoides, dependiendo del sexo).
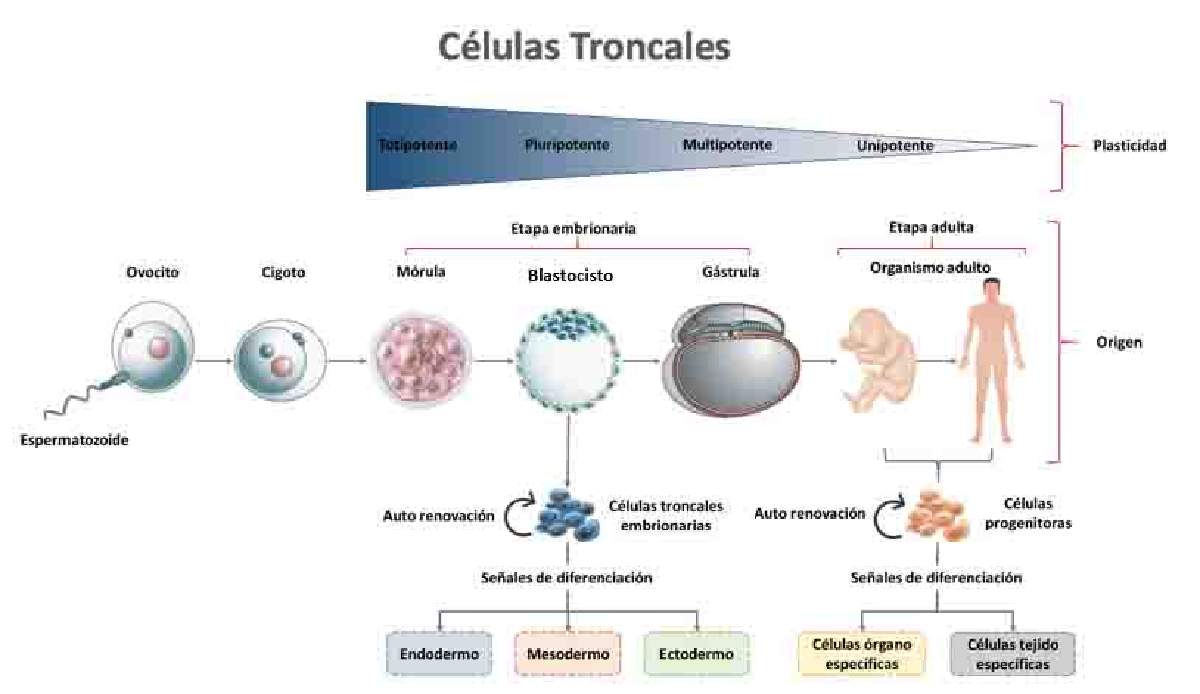
Figura 1. Células troncales y su clasificación. Fuente de la imagen: elaborada por el autor
En la ingeniería de tejidos vasculares, se han investigado procesos de vascularización utilizando diversos modelos de estudio, como las células troncales embrionarias de ratón, las células mesenquimatosas, las células progenitoras endoteliales humanas (CPEH) y las células troncales pluripotentes inducidas (iPSC, por sus siglas en inglés). El objetivo es desarrollar soluciones innovadoras para enfermedades cardiovasculares como la ateroesclerosis, la trombosis, las fístulas arteriovenosas y los aneurismas, entre otras. Las células progenitoras endoteliales humanas (CPEH), pueden encontrarse en el torrente sanguíneo en un porcentaje muy pequeño (entre 0.1 a 0.001%), en función de la edad y comorbilidades de los pacientes. Estas células pueden ser de utilidad en terapias autólogas (en donde se toman células del propio paciente, evitando el rechazo inmune) con un amplio impacto en medicina regenerativa debido a su capacidad para contribuir a la reparación y regeneración de tejidos vasculares dañados. Se ha demostrado que el trasplante de estas células puede producir una formación de nuevas estructuras vasculares en miocardio y miembros inferiores isquémicos. Las CPEH pueden también ser modificadas genéticamente para sobre expresar distintas moléculas antitrombóticas, vasodilatadoras, angiogénicas y antiproliferativas. Así es: células que producirán sustancias que prevengan o corrijan enfermedades vasculares. En algunos casos, es crucial diseñar y fabricar sustitutos vasculares que puedan integrar y funcionar adecuadamente dentro del sistema vascular del paciente. Algunos de los desarrollados para poder contrarrestar enfermedades vasculares es un sustituto vascular que integra nanofibras de biopolímero y CPEH, así como un sistema de microfluidos que actualmente se encuentra en etapa de experimentación. Estos esfuerzos buscan ofrecer alternativas efectivas y personalizadas para el tratamiento de condiciones vasculares complejas, mejorando así la calidad de vida de los pacientes afectados.
Panorama global de obtención de sustitutos vasculares humanos
Un enfoque de escalamiento implementado en la producción de sustitutos vasculares que hemos desarrollado como grupo de trabajo:
- La selección de células progenitoras endoteliales (CPE) a partir de sangre periférica (Figura 2) es un paso fundamental en la ingeniería de tejidos vasculares. Estos procedimientos buscan obtener células con alta capacidad de proliferación y diferenciación. Estas células se pueden obtener mediante un procedimiento llamado aféresis, en el cual se extrae una cantidad de sangre del paciente y se separan las células progenitoras endoteliales utilizando técnicas de separación celular, como el “cell sorting” por citometría de flujo o bien un “cultivo selectivo”, permitiendo separar células individuales de una muestra compleja en función de características específicas, como tamaño, complejidad interna, y marcadores de superficie. En el proceso de cell sorting, las células se suspenden en un flujo líquido y pasan a través de un sistema de láseres que mide diferentes propiedades ópticas (fluorescencia y dispersión de luz) de cada célula. Con base en estas señales, las células pueden clasificarse y separarse con precisión en tiempo real. Las CPE son seleccionadas por su capacidad de diferenciarse en células endoteliales maduras y por su habilidad para contribuir a la formación de nuevos vasos sanguíneos. Una vez aisladas, las CPE deben ser caracterizadas exhaustivamente para confirmar su identidad y funcionalidad. Esto implica evaluar marcadores específicos de células endoteliales y su capacidad para formar estructuras vasculares en condiciones in vitro e in vivo.
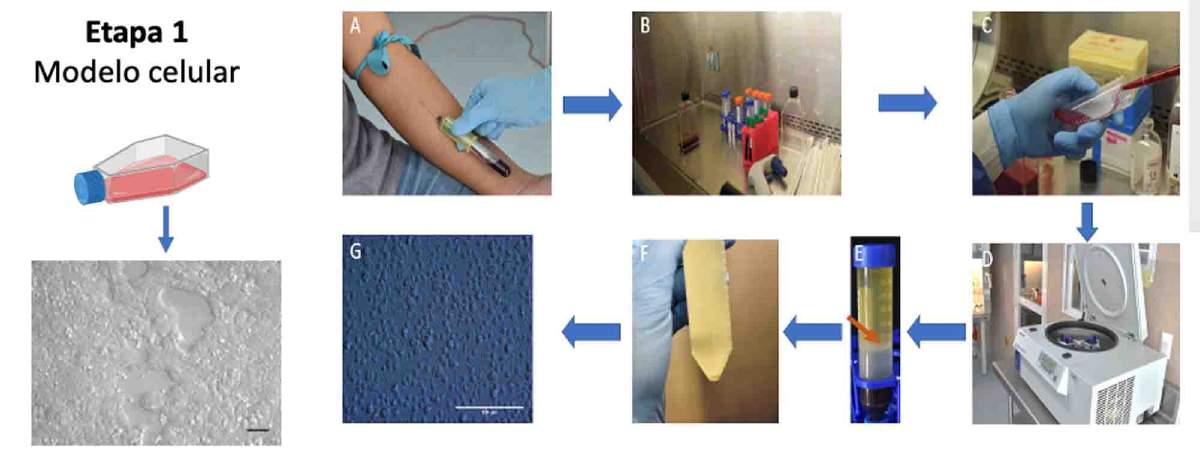
Figura 2. Proceso de obtención de células progenitoras endoteliales humanas (CPEH). La imagen “A” muestra la extracción de sangre periférica humana; las imágenes “B” a “F” ilustran el proceso de separación celular en el laboratorio, y la imagen “G” representa el cultivo de las CPEH. Fuente de la imagen: elaboración propia del autor.
- Expansión a Gran Escala
Después de la selección, las CPE deben ser expandidas a gran escala (escala ascendente) para obtener un número suficiente de células a fin de utilizarlas en ingeniería tisular. La expansión se realiza en bioreactores, que son sistemas diseñados para proporcionar un entorno controlado que favorece la proliferación celular. Estos bioreactores permiten la manipulación precisa de las condiciones de cultivo, como la temperatura, el pH y los nutrientes, para maximizar la producción de células.
Durante esta fase, es crucial asegurar la calidad y la estabilidad de las células. Se realizan análisis regulares para verificar la viabilidad celular, la proliferación, pureza y funcionalidad de la población celular expandida (Figura 3).
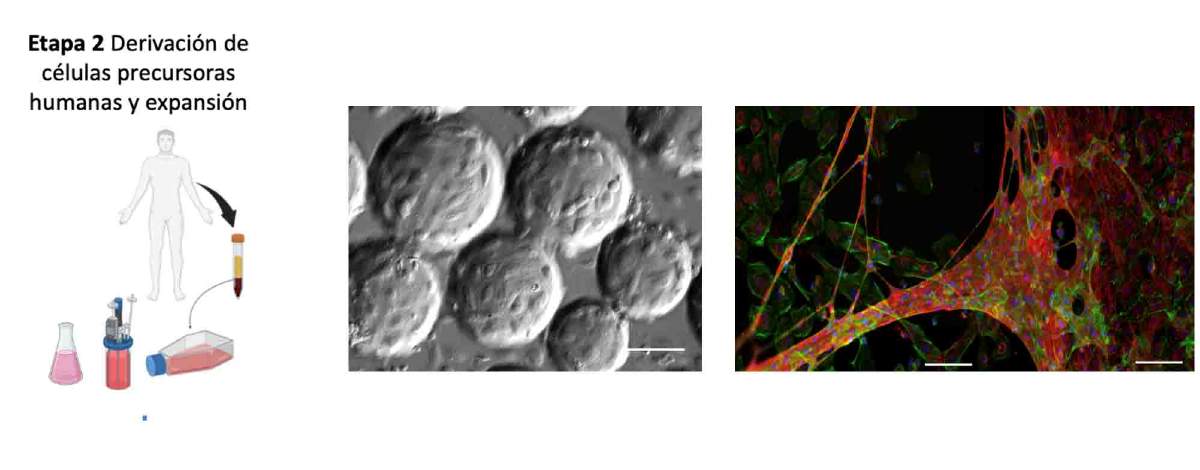
Figura 3. Proceso de expansión celular y evaluación de funcionalidad. La imagen muestra el crecimiento de células endoteliales en microesferas de colágeno cultivadas en un bioreactor. A la derecha, se observa la capacidad de estas células para formar estructuras vasculares, visualizadas en tonos rojizos mediante la técnica de inmunofluorescencia. Fuente de la imagen: elaboración propia del autor.
- Integración de CPE en Nanofibras y/o Hidrogeles Biocompatibles
Una vez que se cuenta con un número suficiente de CPE humanas, el siguiente paso es su cultivo e integración en nanofibras de proteínas (por ejemplo colágeno) obtenidas por electrohilado y/o en hidrogeles biocompatibles. El electrohilado es una técnica que utiliza un campo eléctrico para generar fibras con diámetros nanométricos de materiales biocompatibles, formando una estructura porosa que imita la matriz extracelular del tejido vascular. Estas fibras proporcionan un andamio que apoya el crecimiento celular y la formación de tejido vascular.
Los hidrogeles son polímeros que pueden retener grandes cantidades de agua, creando un entorno tridimensional húmedo que favorece la viabilidad y la funcionalidad celular. Al combinar hidrogeles con andamios de electrohilado, se proporciona un entorno ideal para la diferenciación de las CPE en células endoteliales maduras y su organización en una estructura vascular funcional (Figura 4).
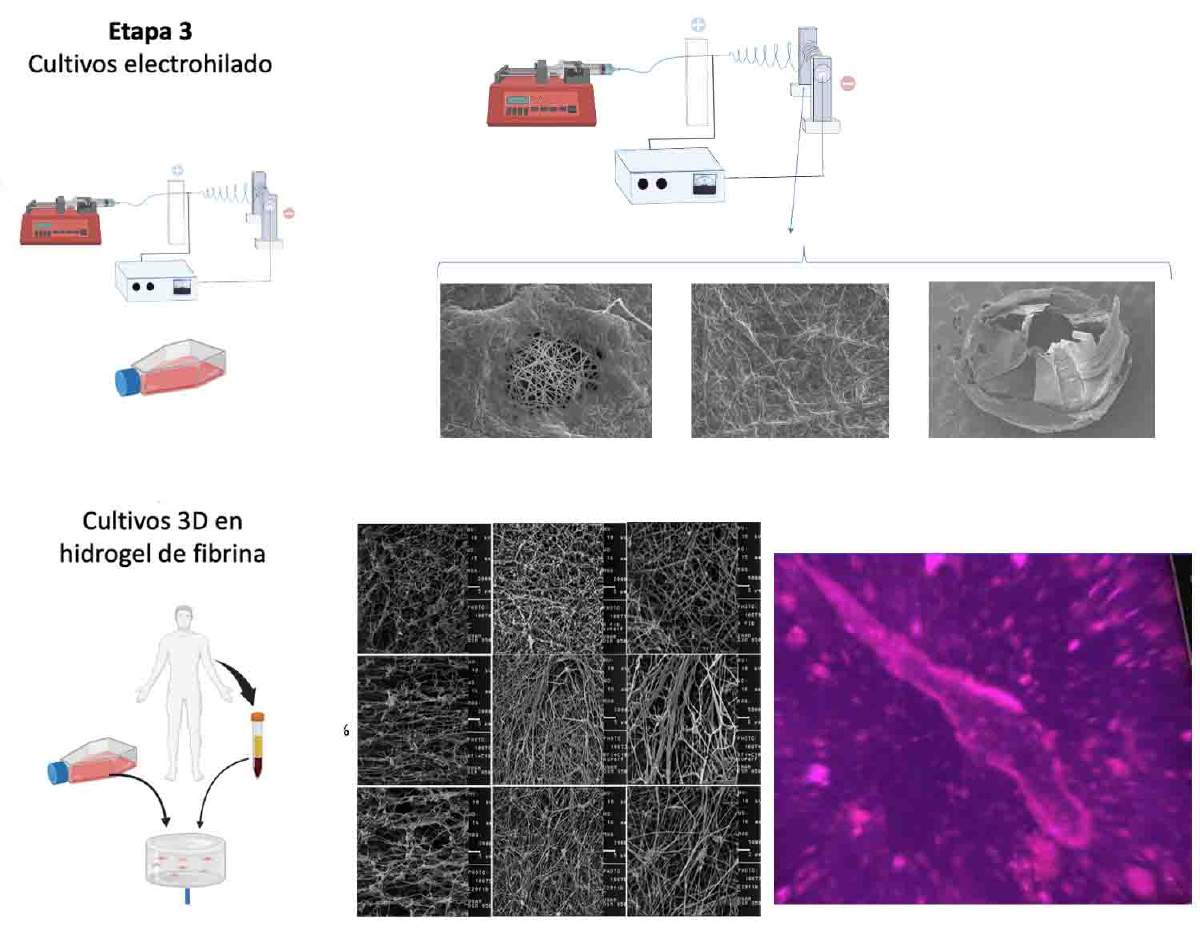
Figura 4. Proceso de integración de células progenitoras endoteliales (CPEH) en matrices tridimensionales. Las imágenes superiores ilustran el desarrollo de un andamio vascular mediante la técnica de electrohilado. En las imágenes inferiores, se observa que, en hidrogeles de fibrina, las células tienen la capacidad de formar estructuras microvasculares (fotografía en tonos violetas). Fuente de la imagen: elaboración propia del autor.
- Estudios preclínicos de sustitutos vasculares: Estas pruebas se llevan a cabo en modelos animales para evaluar la biocompatibilidad y la funcionalidad del sustituto vascular (Figura 5). Se examina la capacidad del injerto para integrarse con el tejido anfitrión, su resistencia a la trombosis, y la funcionalidad del tejido vascular.
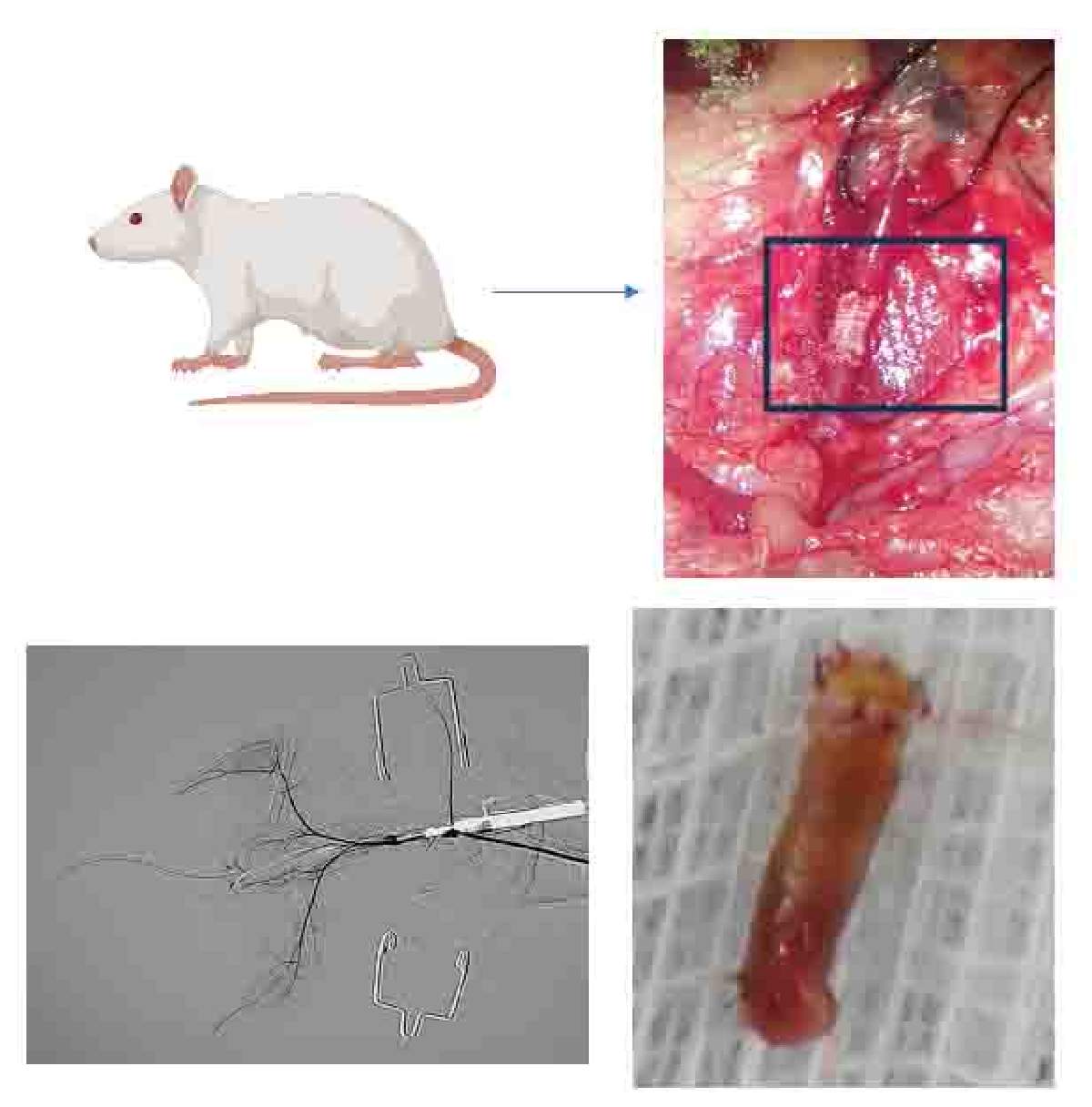
Figura 5. Pruebas preclínicas de sustitutos vasculares. Se implantaron sustitutos vasculares generados por técnica de electrohilado y recubiertos de células endoteliales en sustitución de la aorta de modelos animales. Fuente de la imagen: desarrollada por el autor
Conclusión
La generación de tejidos vasculares artificiales personalizados y funcionales es uno de los grandes retos en la medicina regenerativa y la cirugía cardiovascular. Este proyecto se ha centrado en seleccionar células progenitoras endoteliales (CPE) de sangre periférica humana y su expansión en condiciones de cultivo a gran escala para integrarlas en nanofibras e hidrogeles. Además, se realizan pruebas preclínicas para validar la eficacia y funcionalidad de estos sustitutos vasculares. Esta investigación representa un avance significativo, ya que optimiza la generación de injertos vasculares personalizados, ofreciendo una alternativa segura y eficaz para pacientes con enfermedades crónico-degenerativas que requieren sustitutos vasculares.
El impacto potencial de estas tecnologías es enorme. La integración de células troncales en biomateriales avanzados permite desarrollar estructuras vasculares que, al implantarse, pueden mejorar la circulación en pacientes con comorbilidades derivadas de la diabetes, la hipertensión o la aterosclerosis. Al permitir la regeneración de los vasos sanguíneos, estos injertos podrían reducir complicaciones y mejorar la calidad de vida de quienes enfrentan problemas vasculares graves.
Es importante destacar que este tipo de investigaciones no solo son de interés local, sino que tienen una relevancia mundial. Los avances logrados en CICATA IPN en Morelos están alineados con el esfuerzo global por mejorar las opciones terapéuticas en medicina regenerativa, demostrando que México está a la vanguardia en este campo. La ingeniería de tejidos vasculares está pasando de ser un sueño a una realidad tangible, con el potencial de revolucionar el tratamiento de enfermedades cardiovasculares y mejorar los resultados para pacientes en todo el planeta.
Si te ha interesado el tema, te recomiendo las siguientes referencias:
Bompais, H., Chagraoui, J., Canron, X., Crisan, M., Liu, X. H., Anjo, A., Tolla-Le Port, C., Leboeuf, M., Charbord, P., Bikfalvi, A., & Uzan, G. (2004). Human endothelial cells derived from circulating progenitors display specific functional properties compared with mature vessel wall endothelial cells. Blood, 103(7), 2577-2584. doi: 10.1182/blood-2003-08-2770
Burger, D. & Touyz, R. (2012). Cellular biomarkers of endothelial health: microparticles, endothelial progenitor cells, and circulating endothelial cells. J. American Society of Hypertension. 6(2):85-99. doi: 10.1016/j.jash.2011.11.003
Fuchs, S., Hermanns, M., Kirkpatrick, C. (2006). Retention of a differentiated endothelial phenotype by outgrowth endothelial cells isolated from human peripheral blood and expanded in long-term cultures. Cell Tissue Research. 326 (1): 79- 92. doi: 10.1007/s00441-006-0222-4
Santillán-Cortez, D.; Vera-Gómez, E.; Hernández-Patricio, A.; Ruíz-Hernández, A.S.; Gutiérrez-Buendía, J.A.; De la Vega-Moreno, K.; Rizo-García, Y.A.; Loman-Zuñiga, O.A.; Escotto-Sánchez, I.; Rodríguez-Trejo, J.M.; Tellez-González, M.A.; Toledo-Lozano, C.G.; Ortega-Rosas, T.; García, S.; Mondragón-Terán, P.; Suárez-Cuenca, A. (2023). Endothelial progenitor cells may be related to major amputation after angioplasty in patients with critical limb ischemia. Cells, 12, 584. https://doi.org/10.3390/cells12040584.
Tagawa, S., Nakanishi, C., Mori, M., Yoshimuta, T., Yoshida, S., Shimojima, M., Yokawa, J., Kawashiri, M., Yamagishi, M. & Hayashi, K. (2015). Determination of early and late endothelial progenitor cells in peripheral circulation and their clinical association with coronary artery disease. International Journal of Vascular Medicine, 2015: 674213. doi: 10.1155/2015/674213
Jiménez-Beltrán, M.A.; Gómez-Calderón, A.J.; Quintanar-Zúñiga, R.E.; Santillán-Cortez, D.; Téllez-González, M.A.; Suárez-Cuenca, J.A.; García, S.; Mondragón-Terán, P. (2022). Electrospinning-generated nanofiber scaffolds suitable for integration of primary human circulating endothelial progenitor cells. Polymers, 14, 2448. https://doi.org/10.3390/polym14122448
Padilla, L., Argüero‐Sánchez, R., Rodríguez‐Trejo, J. M., Carranza‐Castro, P. H., Suárez‐Cuenca, J. A., Polaco‐Castillo, J., ... & Mondragón‐Terán, P. (2020). Effect of autologous transplant of peripheral blood mononuclear cells in combination with proangiogenic factors during experimental revascularization of lower limb ischemia. Journal of Tissue Engineering and Regenerative Medicine, 14(4), 600-608. https://doi.org/10.1002/term.3024
Santillán-Cortez, D.; Vera-Gómez, E.; Hernández-Patricio, A.; Ruíz-Hernández, A.S.; Gutiérrez-Buendía, J.A.; De la Vega-Moreno, K.; Rizo-García, Y.A.; Loman-Zuñiga, O.A.; Escotto-Sánchez, I.; Rodríguez-Trejo, J.M.; et al. (2023). Endothelial progenitor cells may be related to major amputation after angioplasty in patients with critical limb ischemia. Cells, 12, 584. https://doi.org/10.3390/cells12040584
Esta columna se prepara y edita semana con semana, en conjunto con investigadores morelenses convencidos del valor del conocimiento científico para el desarrollo social y económico de Morelos.


