El Dr. del Río Portilla es físico y doctor en ciencias por la Facultad de Ciencias de la UNAM. Distinguido con el Premio Weizmann por su tesis doctoral, Premio Efraín Hernández Xolocotzi por la Universidad de Chapingo, Medalla de Honor en Ciencia y Tecnología otorgada por el Congreso del Estado de Morelos, Medalla VASE, Reconocimiento al Mérito Estatal en Investigación REMEI 2021 por las contribuciones a la Divulgación y Vinculación y Premio Universidad Nacional 2023 en el área de Innovación tecnológica y diseño industrial. Director fundador el Centro Morelense de Innovación y Transferencia Tecnológica (2007-2008), primer director del Instituto de Energías Renovables de la UNAM (2013-2021) y actual director del Centro de Estudios Mexicanos Reino Unido de la UNAM. Es miembro de las academias Mexicana de Ciencias, de Ingeniería de México y de Ciencias de Morelos.
El Dr. Herrera Castro es Ingeniero Químico por el Instituto Tecnológico de Tepic y Doctor en Ciencias Químicas por el Centro de Investigación y de Estudios Avanzados del IPN. Actualmente es investigador Posdoctoral en el Instituto de Energías Renovables de la UNAM. Es miembro del SNII y sus líneas de investigación e intereses profesionales son la termodinámica fuera de equilibrio y los fenómenos de transporte.
Esta publicación fue revisada por el comité editorial de la Academia de Ciencias de Morelos.
-He estado pensando últimamente acerca de lo limitada que es la física.
-¿A qué te refieres? En los últimos 100 años hemos tenido avances increíbles, sobre todo con la relatividad y la mecánica cuántica.
Estábamos al lado de la cafetera exprés del instituto y como siempre empezábamos a disfrutar de un café, pero conversando sobre temas que podrían ser temas cotidianos, de política, científicos o problemas científicos que no tienen solución o que se acaban de resolver.
-Pues sí, todo eso es importante; pero ponte a pensar en que nuestros formalismos todavía no pueden abordar con mucho éxito sistemas complejos.
-No entiendo a que te refieres.
-Me refiero que muchos modelos matemáticos y sus ecuaciones describen procesos idealizados con muchas aproximaciones e hipótesis que permiten desarrollarlos y tener respuestas sencillas. Un ejemplo de esto es la termodinámica.
-Pero si la termodinámica ha podido describir muchos sistemas particulares, inclusive los motores de combustión interna.
-Si, pero todo lo que hemos podido estudiar con la teoría de la termodinámica clásica son las transformaciones de la energía entre estados de equilibrio. Y los procesos reales no suceden entre estados de equilibrio (Figura 1).
-¿Entonces lo que me han enseñado acerca de ciclos termodinámicos o cinética química, como la ley de Arrhenius o la ley de Fourier o la Ley de Ohm, se basa en las condiciones idealizadas de sistemas reales?

Figura 1. Imagen generada con inteligencia artificial mediante la frase “Create a realistic image of a modern chemical laboratory where a man and a woman are working together, closely observing colorful reactions in lab equipment and comparing a curve in a blackboard with their experiments. The scene should include glass beakers, and flasks filled with vibrant, glowing mixed colored liquids. The lab is well-lit, with a professional yet dynamic atmosphere, capturing the excitement of scientific discovery. Both individuals wear lab coats, safety goggles, and gloves, focused on their experiment as they analyze the reactions taking place.” en leonardo.ai
-Exactamente. Nada más contradictorio que la descripción de los fenómenos que suceden con diferencias de temperatura con una teoría de equilibrio. Sucede que en las clases de termodinámica clásica siempre nos dicen que las explicaciones son para estados de equilibrio, pero nada en el mundo real está en equilibrio.
- Si así es, la definición de estado de equilibrio en termodinámica es que las propiedades como la temperatura, presión, magnetización no cambian con el tiempo y toman los mismos valores para todo el sistema [1].
- Eso, cuando has visto que en una habitación o en un cuerpo la temperatura sea la misma, casi siempre hay pequeñas diferencias de temperatura a lo largo de los cuerpos o del tiempo.
- Por esto me llamó la atención este artículo, que salió publicado este año, que habla de una aproximación variacional a las reacciones químicas más allá del equilibrio [2].
- ¡Ah! Déjame verlo... los principios variacionales son herramientas matemáticas sofisticadas que contribuyeron significativamente al desarrollo de la física teórica y están presentes en lo que hoy llamamos inteligencia artificial.
- Si por eso me intrigó, ¿cómo se puede usar un principio variacional en algo tan alejado del equilibrio como las reacciones químicas?
- Esto parece estar muy en la frontera de la química... mucho más allá de lo básico.
- Definitivamente, en este artículo dejan atrás las reacciones químicas simples y desarrollan un formalismo matemático para reacciones lejos del equilibrio.
- ¿Lejos del equilibrio?, eso suena un poco intenso. ¿Qué significa eso?
- Mira, imaginemos una reacción química como la interacción entre dos o más personas en una ciudad para producir algún bien. Entran componentes y de su trabajo, digamos interacción, salen bienes. Hasta cierto punto, este comportamiento es predecible, pero sólo en equilibrio.
- Va, lo estoy imaginando. Entonces lo que importa es lo que entra y sale para llegar a una situación de constante producción del bien y lo podemos describir con la teoría de equilibrio.
-Así es. Ahora imagina el estado de no equilibrio como si estas personas están en la ciudad casi a la hora pico del tráfico. Todo se mueve con cierto caos, algunas partes van rápido otros van lento, sin un movimiento “coherente”, aparentemente; sin embargo, a pesar de todo esto, la interacción entre las personas o la reacción llega a producir lo que se necesita, aunque toda la trayectoria sea un “desorden”, por decirlo de una manera.
- Si normalmente es así cómo se analizan las reacciones, donde lo que interesa es que siempre se produzca lo mismo. A esto le podríamos llamar que se llega al estado estacionario, porque no cambia en el tiempo.
- De acuerdo, pero eso implica que no se describen las situaciones que conducen a ese estado estacionario.
- Pero eso no permite analizar con detalle cómo se llega al estado estacionario.
- Efectivamente has tocado un punto muy fino, y es que de acuerdo con Ilya Prigogine, un ganador del premio Nobel, los estados estacionarios son los que menos producción de entropía tienen.
- MmH... Recuerdo que en la naturaleza, los procesos tienden a ir de un estado de menor entropía a uno de mayor entropía. Por ejemplo, un cubo de hielo en una bebida caliente se derrite porque el sistema (hielo + bebida) pasa de un estado más ordenado (hielo sólido) a uno más desordenado (agua líquida). Al derretirse el cubo de hielo se produce entropía.
-Al incrementarse la entropía el proceso es irreversible.
- ¡Ah! Entonces... si no estudiamos los transitorios no podemos disminuir las irreversibilidades y hacer los procesos más sustentables. ¡Qué cosa tan interesante! Ligar a la sustentabilidad con la termodinámica parece ser una tarea que suena prometedora, pues al disminuir las irreversibilidades podemos hacer que los procesos se aproximen a la sustentabilidad, parece que tiene sentido eso de economía cíclica. Cuando al llegar al fin de la vida los productos se pudieran reciclar y con ello disminuir los desperdicios. En el lenguaje de la termodinámica sería disminuir las disipaciones y con ello la entropía.
Nos quedamos pensando en estos temas, sorbimos otro poco de café y continuamos.
- Bueno... bueno... eso parece una interesante hipótesis, ligar la sustentabilidad con evitar las irreversibilidades. Pero... Regresemos al artículo, en un punto señalan que su metodología tiene forma de considerar la memoria.
- ¿Cómo? ¿Las reacciones químicas tienen memoria? Barajéamela más despacio.
- La comunidad que estudia la termodinámica, dice que cuando un proceso recuerda su pasado dinámico tiene memoria.
- La verdad es que no me aclaras mucho, ¿qué es eso de su pasado dinámico?
- Podemos pensar que una forma sencilla de explicar esto de la memoria es considerar que los procesos siguen caminos diferentes si además de un estado inicial se requiere conocer la rapidez con la que los cambios venían sucediendo.
- Ya entiendo, muchos modelos matemáticos requieren conocer la condición inicial, por ejemplo: la trayectoria de una pelota cayendo depende de la altura donde está y de la velocidad que tiene en el momento de soltarla.
- Exacto, ese es un ejemplo muy sencillo de que el estado dinámico determina el futuro, la trayectoria de la pelota. Si soltamos una pelota sin darle una velocidad al principio, solamente cae; pero si al momento de soltarla le damos un empujón hacia algún lado, es decir, tiene una velocidad inicial, la trayectoria cambia y en lugar de ser una línea recta en la caída, es curva y se asemeja mucho a una parábola y la forma de esa parábola cambia tanto con la dirección como la rapidez de ese impulso inicial.
- Ya voy comprendiendo... pero ¿Y esa memoria qué tiene que ver con las reacciones químicas?
- Pues sucede que las reacciones químicas alejadas del equilibrio conducen a resultados diferentes dependiendo del cambio en la velocidad de reacción al momento de empezar a analizarla.
- ¡Guau! ¡Qué cosa! Entonces el producto final no solo depende de la velocidad de la reacción, sino de si esta velocidad iba en aumento o disminución en el momento de describirla.
- Sí, así es y algo interesante es que en el artículo tuvieron que utilizar no solo modelos variacionales, sino los conceptos de la Termodinámica Irreversible Extendida [3, 4].
- Vale, ahora estás usando palabras rimbombantes para hacerme sentir menos.
- ¡Uhh!, no, no es tan aterrador como suena. Básicamente es una manera de pensar en sistemas donde las cosas son un poco más complicadas. Mira, la idea detrás de la Termodinámica Irreversible Extendida (TIE) es considerar no solo las variables como temperatura o concentración de substancias como las relevantes del problema e incluye variables como el flujo de masa o la velocidad de reacción. De ahí su nombre, el espacio termodinámico se “extiende”, para dar lugar a estas variables.
- Pero los flujos generalmente son proporcionales a los gradientes, cambios, de las variables como temperatura o concentración. A esas se les llama las relaciones constitutivas como la Ley de Fick o la de Fourier que usamos en los cursos de transferencia de masa y calor.
- De acuerdo. Creo que estamos empezando a comprenderlo, pero con esta formulación extendida se considera que esas ecuaciones constitutivas ya no son válidas todo el tiempo, sino que se pueden ver como válidas en el estado estacionario o, hablando con mayor propiedad, en equilibrio local. Al no ser válidas se tiene que construir una manera de obtener ecuaciones equivalentes. El procedimiento tradicional en la TIE conduce a ecuaciones aproximadas para los flujos; pero que requieren el conocimiento de las derivadas de los flujos y con ello se incorpora la memoria.
- Ahora sí lo veo, en lugar de tener al flujo de calor proporcional al cambio espacial en la temperatura, lo que se llama gradiente de temperatura, se tiene que el cambio en el flujo de calor es proporcional al flujo y al gradiente de la temperatura. Así se incluye la memoria. Bueno, pero, en este artículo se dice que el formalismo variacional conduce a ecuaciones exactas que tienen memoria.
- Así es, la formulación variacional conduce a ecuaciones exactas; pero muy complicadas de resolver en conjunto con las ecuaciones de balance de masa, energía y demás.
- Veo que la memoria ha sido un gran problema para el mundo de la química, pero hablemos del panorama más amplio por un segundo. ¿Cómo podría esta investigación realmente impactar nuestra vida cotidiana?
- Imaginemos ser capaces de diseñar procesos químicos que sean mucho más respetuosos con el medio ambiente y que no produzcan tanta entropía para que generen menores disipaciones, que sean menos irreversibles.
- Podríamos hacer que todo, desde la medicina hasta los plásticos sean mucho más sustentables.
- De eso hablo.
- Así que estamos comentando sobre algunas cosas innovadoras, pero antes de continuar, quiero saber cómo lo hicieron realmente. ¿Ya lo entendiste? ¿Puedes guiarme por esta investigación?
- Claro. Así que para abordar la complejidad de estas reacciones, utilizan algo llamado invariantes escalares.
- ¡Ay! esas palabras raras de nuevo.
-Sí, lo siento. Pero piensa en estos invariantes escalares como representaciones simplificadas de lo que está pasando en el sistema. ¿Recuerdas la clase de geometría analítica en el bachillerato?
- Esa… la de los vectores.
- Sí, esa mera, y que bueno que mencionaste a los vectores. Recuerdas que podemos decir que los vectores son flechas en el espacio.
- Claro, decíamos que eran flechas con magnitud, dirección y sentido.
- Efectivamente. En el caso de los vectores su tamaño o magnitud es un invariante con respecto a la selección del sistema de coordenadas.
- Y esto ¿qué tiene que ver con la termodinámica?
- En este caso de las reacciones químicas fuera del equilibrio, su termodinámica involucra variables que no son las tradicionales de la termodinámica de equilibrio y se construye un espacio termodinámico extendido con las nuevas variables.
- Entonces existe un espacio termodinámico.
- Así es, como ya mencionamos en la termodinámica irreversible extendida se postula la existencia de un espacio de variables termodinámicas otorgando independencia a los flujos y ya no son funciones directas de la concentración y temperatura.
- Como ya mencionamos, ya no valen las llamadas ecuaciones constitutivas como la Ley de Fourier o la Ley de Fick.
- Así es. Ahora los flujos se consideran variables independientes, pero estas variables tienen características matemáticas diferentes. Algunas son escalares y otras vectores y otras más tensores.
- ¡Uf… Uf! ya se complicó el asunto.
- Pues el tratamiento matemático sí, pero no la idea. Mira, la propuesta es muy sencilla. En este trabajo se considera que todas las variables termodinámicas, las de equilibrio y los flujos, conforman un nuevo espacio, pero algunas como el flujo de masa o el flujo de calor son vectores, y sus componentes varían con los sistemas de coordenadas, entonces se usan solamente las magnitudes y otras propiedades que no cambian con el sistema de coordenadas.
- ¡Ah! y esos valores que no cambian son los invariantes que mencionaste.
- Efectivamente, las magnitudes y otras propiedades de las variables termodinámicas, los que llaman invariantes escalares, son las que se usan para describir los estados fuera de equilibrio de las reacciones químicas en situaciones alejadas del equilibrio.
- Así que, en lugar de perderse en cada pequeño detalle, pueden concentrarse en la descripción basada en esos invariantes, pero eso es estar en el mundo matemático y abstracto.
- No necesariamente, y para probar que no sólo están trabajando matemáticas abstractas, realmente han puesto a prueba su modelo.
- ¿Cómo hacen eso?
- Usan la catálisis enzimática como un ejemplo real.
- Esto significa que su modelo no es sólo una idea teórica, sino que tiene un uso práctico.
- Así es. Usaron datos de otro artículo y encontraron que al transformar matemáticamente esos datos experimentales obtenían la relaciones que predicen con su formulación variacional.
- Así que usaron experimentos de otras personas para validar sus hallazgos teóricos.
- Sí, se basaron en experimentos para mostrar que las ecuaciones que predicen describen el mundo real. Mira la gráfica que pusieron en el artículo. Aquí la muestro trazando una linea roja entre los datos que presentan en el artículo [2] con sus cálculos (Figura 2).
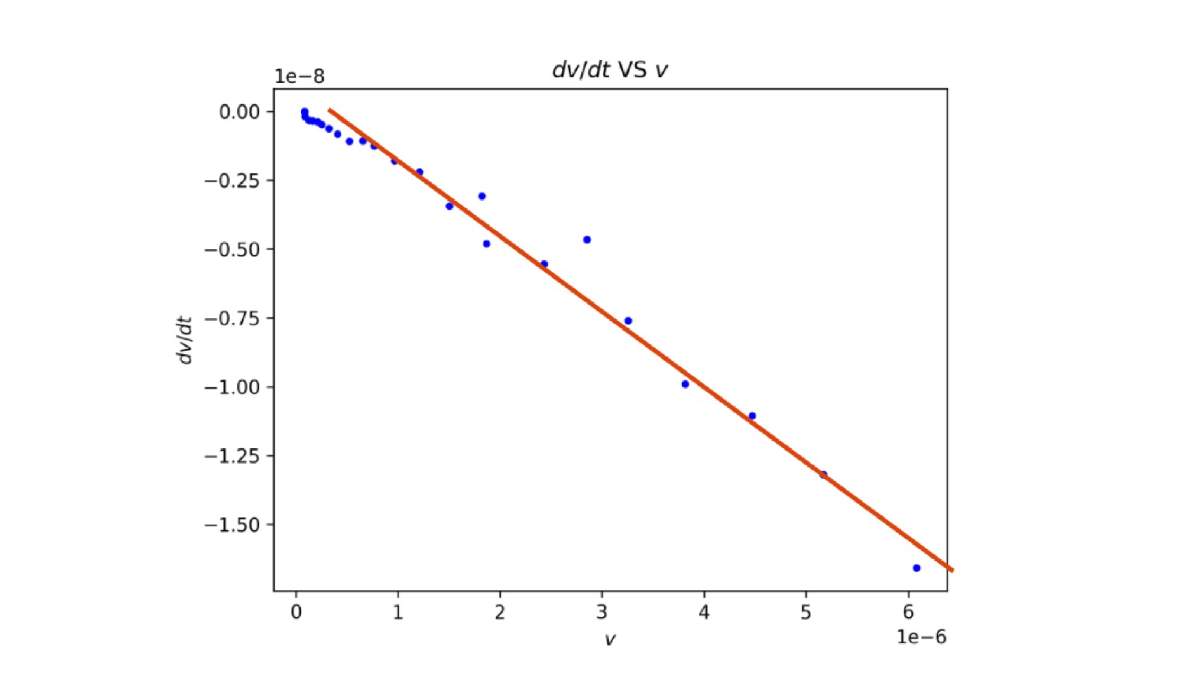
Figura 2. Se observa que la línea roja ayuda a guiar a nuestros ojos para ver el alineamiento de los datos experimentales. Gráfica modificada del artículo J. Non-Equilib. Thermodyn. 2025; 50(1): 185–197.
- ¡Ah! sí, la tendencia que predice su teoría dice que la derivada de la velocidad de reacción es una función lineal de la velocidad de reacción y se observa perfectamente en su gráfica, los puntos experimentales se alínean. Entonces este formalismo tiene el potencial de describir realmente las reacciones químicas. Estoy empezando a ver un panorama más amplio aquí y es bastante alucinante cómo un formalismo totalmente teórico describe las reacciones químicas más allá del equilibrio. ¿Cómo se podría utilizar esta investigación para hacer que los compuestos de las reacciones químicas sean amigables con el ambiente?
- Esa es una gran pregunta. Recuerda, las reacciones químicas son fenómenos verdaderamente complejos. El estudio demuestra cómo describir las reacciones químicas fuera del equilibrio conduce a memoria y podría tener un impacto realmente tangible en nuestra vida cotidiana.
- Es como si nos hubieran dado un vistazo al futuro de la tecnología de baterías, donde la descripción cuantitativa de las reacciones químicas es esencial. Pero, al principio mencionaste que esta investigación también podría impactar en otros campos más allá de la química, incluso cosas como la economía y las redes sociales.
- Puede parecer algo aventurado, pero piénsalo. Las economías tratan de la interacción. Las empresas individuales, los gobiernos, están constantemente intercambiando información y en general, bienes.
- Ah! Entonces, en las empresas pueden suceder algo como reacciones químicas y salir productos o servicios, digamos bienes y, en principio, las ecuaciones para describir estos procesos económicos se podrían parecer a las reacciones químicas.
- Así es, en algunas propuestas de este tipo en el siglo pasado se les llamó Termoeconomía.
- Imagínate poder usar herramientas como esta termodinámica irreversible extendida en su forma variacional para entender realmente cómo funcionan esos sistemas y tal vez incluso predecir cómo reaccionarán ante diferentes cambios.
- También cómo entender los procesos que ocurren en nuestro medio ambiente.
- Ahora estoy vislumbrando lo amplio que este formalismo podría ser. Es como si esta investigación abriera una puerta a una nueva forma de ver el mundo, desde pequeñas reacciones a los enormes sistemas que son parte de nuestras vidas.
- Absolutamente.
- Y destaca lo importante que es pensar en todas las disciplinas para derribar esos muros entre diferentes campos y buscar esas analogías. Porque están ahí, incluso cuando no los vemos al principio. Y a veces todo lo que se necesita es una nueva perspectiva para cambiar completamente cómo entendemos cómo entendemos cómo eran las cosas.
- Exactamente y es increíble pensar que este artículo científico, como muchos otros que construyen conocimiento pueden describir fenómenos que a primera vista parecen no estar relacionados.
Como siempre las conversaciones pasan muy rápido y después de beber las respectivas tazas de café retornamos a nuestro trabajo de preparar la clase o de concluir una medición en el laboratorio o escribir nuestros más recientes hallazgos. Y también como siempre, estas conversaciones estimulan nuestra imaginación y nos hacen confiar en un mejor futuro con la luz de la ciencia.
Referencias
[1] J. del Río P., F. Vázquez H., and P. Sánchez P., “On the states of thermodynamic equilibrium”, Rev. Mex. Fís., vol. 34, no. 4, pp. 670–676, Jan. 1987. https://rmf.smf.mx/ojs/index.php/rmf/article/view/2024
[2] Herrera-Castro, Filiberto and del Río, Jesus Antonio. "Variational approach to chemical reactions beyond local equilibrium" Journal of Non-Equilibrium Thermodynamics, vol. 50, no. 1, pp. 185-197, 2025. https://doi.org/10.1515/jnet-2024-0072
[3] Leopoldo García Colín., “Extended non-equilibrium thermodynamics, scope and limitations”, Rev. Mex. Fís., vol. 34, no. 3, pp. 344–366, Jan. 1987. https://rmf.smf.mx/ojs/index.php/rmf/article/view/1992
[4] M. López de Haro, J. del Río, F. Vázquez, and S. Cuevas, “On the contribution of the mexican school to extended irreversible thermodynamics”, Rev. Mex. Fís., vol. 39, no. 1, pp. 63–76, Jan. 1992. https://rmf.smf.mx/ojs/index.php/rmf/article/view/2304/2272
Esta columna se prepara y edita semana con semana, en conjunto con investigadores morelenses convencidos del valor del conocimiento científico para el desarrollo social y económico de Morelos.


