Mayra Avelar Frausto. La Dra. Avelar es actualmente una joven investigadora en estancia posdoctoral en la Universidad Autónoma de Zacatecas. Es graduada del Posgrado en Ciencias Bioquímicas de la UNAM, y realizó sus estudios en el Instituto de Biotecnología de la UNAM, campus Morelos.
Marcela Ayala Aceves. La Dra. Ayala es investigadora titular en el Instituto de Biotecnología de la UNAM, en donde dirige un laboratorio dedicado al estudio de enzimas. Es miembro de la Academia de Ciencias de Morelos, y contribuye regularmente con esta sección.
Esta publicación fue revisada por el comité editorial de la Academia de Ciencias de Morelos.
La Biotecnología Moderna: no podríamos vivir sin ella.
La biotecnología será sin duda un motor importante de progreso en el siglo XXI. Utilizando materias primas renovables y el uso de microorganismos o sus partes, la biotecnología nos ha permitido desarrollar bioprocesos para la producción de compuestos de uso industrial (acrilamida, enzimas para detergentes, productos de cuidado personal, gomas, etc.), suplementos alimenticios (vitaminas y aminoácidos), alimentos (vino, cerveza, queso), fármacos y terapéuticos (antibióticos, hormonas, anticoagulantes, etc.), bioplásticos (polímeros basados en ácido poli-láctico), bioenergía (biogás, bioetanol), cultivos (soya, algodón, maíz, etc.), entre otros. Los procesos biotecnológicos ayudan a reemplazar o complementar procesos actuales, reducir el uso de petróleo y sus derivados y pavimentar el camino para lograr una industria sostenible y mucho más amigable con el ambiente. Además, gracias a la biotecnología hoy contamos con productos en el área de salud, agricultura y alimentación que sería imposible conseguir con otro tipo de tecnologías. En el área de la salud un ejemplo contundente es el uso de proteínas terapéuticas como es la insulina recombinante humana, producida por bacterias, para tratar la diabetes tipo 1; la estreptoquinasa para tratar coágulos; la penicilino amidasa como antídoto para tratar reacciones alérgicas a la penicilina; entre otros ejemplos, como ya presentamos en una entrega anterior (ver lecturas recomendadas al final de este texto). Por otro lado, en el área de la agricultura y la alimentación, podemos mencionar diversos ejemplos como el arroz dorado, una especie quimérica o transgénica capaz de producir carotenos, y que sería de gran utilidad para tratar la deficiencia de vitamina A en países con problemas de desnutrición, o los jitomates ricos en un precursor de la vitamina D; así mismo podemos mencionar a los cereales transgénicos, que presentan resistencia a plagas o a ciertos pesticidas, reduciendo de esta manera las pérdidas por enfermedad o facilitando la eliminación de maleza, respectivamente; las verduras y frutas como papas, manzanas, jitomates han sido modificadas genéticamente para bloquear o ralentizar los procesos que conducen a su rápida maduración, incrementando así su vida de anaquel y la pérdida del valor nutricional por oxidación y por tanto reduciendo el desperdicio. Todos estos avances se han logrado en los últimos cien años; la biotecnología moderna recién nace en la segunda mitad del siglo pasado y los progresos se aceleran a medida que aumenta nuestro nivel de comprensión de los procesos biológicos, y por tanto mejora nuestra capacidad de manipularlos en nuestro beneficio.
En esta entrega describiremos los logros de algunas científicas que realizaron hallazgos importantes para el desarrollo de la biotecnología moderna, entendida como el uso de la tecnología del ADN recombinante. Ésta consiste en modificar la información genética de un organismo vivo (por ejemplo, un microorganismo como un hongo o una bacteria, en un inicio, pero ahora también animales y plantas) para que desarrollen una nueva función, que puede ir desde la síntesis de una proteína exógena (ajena al organismo) o que adquiera o mejore una ruta metabólica (ingeniería de vías metabólicas) o que deje de realizar funciones normales bloqueando la expresión de un gen. Todo esto se consigue a través de eliminar o insertar en el organismo modificado, genes naturales o sintéticos, de la misma o de diferente especie, o elementos que los regulan.
Cortar y pegar: el descubrimiento de las enzimas de restricción
Esta tecnología del ADN recombinante, explicada de forma muy simplificada en el párrafo anterior, solo es posible gracias al profundo conocimiento de la biología de las células a nivel molecular. Como ocurre en la ciencia, esta poderosa herramienta es el resultado de al menos 150 años de investigaciones, desde el descubrimiento del ADN en el núcleo de glóbulos blancos en 1868 por Friedrich Miescher. Los descubrimientos en biología celular y molecular han permitido desenmarañar lo que ocurre al interior de una célula, que no es más que la perfecta sincronización de miles de reacciones químicas celulares que involucran tanto sustancias sencillas (moléculas pequeñas como la glucosa, iones de calcio, sodio y potasio, ATP, etc.) como macromoléculas de muy alta complejidad (polisacáridos, lípidos, proteínas y ácidos nucleicos).

Janet Mertz, descubridora de las enzimas de restricción. Sigue activa en la Universidad de Wisconsin, EEUU. Fuente de la imagen: www.mujeresconciencia.com
Una de las herramientas esenciales para la manipulación del ADN son las llamadas enzimas de restricción. Éstas son proteínas con actividad catalítica, lo que significa que aceleran reacciones químicas. Específicamente, la reacción que aceleran estas enzimas de restricción es la hidrólisis del ADN en sitios en los que se encuentran secuencias específicas. Respecto al estudio de estas proteínas, podemos mencionar las contribuciones de la científica Janet Mertz, quien es una investigadora que actualmente trabaja en la Universidad de Wisconsin; estudió biología en el Massachusets Institute of Technology (MIT) y posteriormente realizó sus estudios doctorales bajo la tutoría de Paul Berg en la Universidad de Stanford. En este laboratorio en 1972, hace 50 años, Janet descubrió que la enzima EcoR1 era capaz de hidrolizar el ADN en un sitio con una secuencia específica y dejar en el sitio de corte extremos cohesivos, como se ilustra en la Figura 1. La ventaja de estos extremos, como su nombre lo dice, es que pueden unirse a una secuencia complementaria en el extremo cortado. Una consecuencia de este tipo de hidrólisis o corte es que también se puede llevar a cabo el proceso inverso llamado ligación; es decir, la unión de dos fragmentos de ADN con una secuencia complementaria. Este fue un avance importantísimo porque permitió crear ADN quimérico (ADN sintetizado en el laboratorio a partir de dos fragmentos de ADN de origen diferente, por ejemplo, de una bacteria y un virus) de una forma simple. Usando el descubrimiento de Janet, el grupo de Herbert Boyer y Stanley Cohen de la Universidad de California en San Francisco y de la Universidad de Stanford, respectivamente, consiguió obtener bacterias transgénicas para producir varias proteínas de interés médico, entre ellas la insulina humana, llamada recombinante debido a que se combinaron fragmentos de ADN de bacteria y humano. La insulina humana recombinante fue el primer producto de su tipo aprobado para su uso comercial por la agencia de EEUU de Administración de alimentos y medicamentos o FDA por sus siglas en inglés, en 1982.
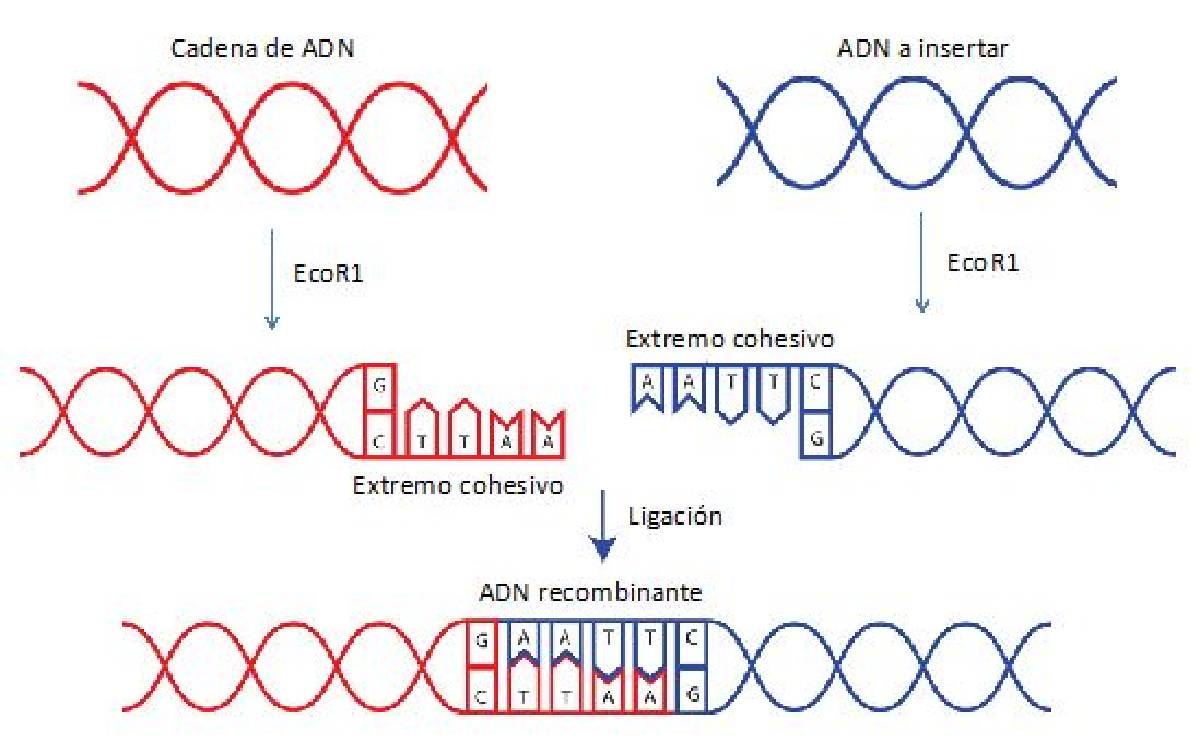
Figura 1. Las enzimas de restricción como EcoR1 cortan el ADN en secuencias específicas, permitiendo la unión de dos cadenas de ADN de orígenes diferentes para obtener ADN recombinante.
El cartero siempre se llama ARNm: desarrollo de vacunas modernas
Otra biotecnóloga destacada es Katalin Karikó, quien nació en Hungría en 1955. Estudió en la Universidad de Szeged en donde obtuvo su doctorado en bioquímica trabajando con ARN mensajero (ARNm). El ARNm es una molécula presente en todos los seres vivos del planeta; sin ella, la vida no podría existir. Sirve de eslabón entre la información contenida en el ADN (genes) y las proteínas codificadas en esas instrucciones genéticas. Podríamos decir que cada fragmento de ADN que codifica para una proteína, se transcribe a un ARNm (muy parecido a ese ADN) el cual, como un cartero, lleva la información hasta donde se encuentran los ribosomas, esas fábricas moleculares que se encargan de traducir la información contenida en la secuencia del ARNm y ensamblar la proteína correspondiente. Katalin decidió mudarse con su familia a EEUU para proseguir su trabajo como científica. Primero en la Universidad de Temple en Filadelfia y después en la Universidad de Pensilvania realizó investigaciones acerca del uso de ARNm para curar enfermedades, sin mucho éxito. Cambiando el enfoque de la aplicación de esta extraordinaria molécula, en colaboración con su colega Drew Weissman intentaron usar el ARNm como vacuna contra el VIH. Se encontraron con varios obstáculos, como la fuerte reacción inmune que causaba en el cuerpo la introducción de ARNm de origen viral, lo que resolvieron al introducir modificaciones en la secuencia que suprimía esta fuerte reacción. Con este avance, y otros relacionados con la estabilidad de la molécula, se abría un camino más transitable hacia la aplicación terapéutica del ARNm, que poco después resultó en la primera vacuna basada en esta molécula. Para conocer más sobre el camino recorrido para llegar a este logro, pueden leer “The tangles history of mRNA vaccines” (ver lecturas recomendadas). La vacuna basada en ARNm depende de poder introducir en nuestro cuerpo, embebido en un vehículo lipídico, un fragmento de ARNm que contiene las instrucciones para producir una sección de la proteína que se encuentra en la superficie de los virus (la proteína espiga, o spike en inglés). Cuando nuestras células se encuentran con este ARNm, hacen lo que harían con cualquier ARNm: empiezan a traducirlo en los ribosomas, formándose dentro de nosotros esa proteína viral. Su presencia alerta al sistema inmune, que inmediatamente comienza a producir anticuerpos que reconocen y neutralizan a esa proteína extraña. Gracias a esto, cuando el virus nos infecte no tomará al sistema inmune desprevenido, por así decirlo. Para mayor detalle, revisar las lecturas recomendadas. Las compañías ModeRNA (acrónimo de RNA modificado) y BioNtech han basado el desarrollo de sus vacunas, en conjunto con Pfizer, contra la COVID-19 en las patentes otorgadas a Katalin y su equipo de colaboradores. En todo el mundo se reconoce su contribución, que ha salvado millones de vidas y seguramente salvará más, de enfermedades diferentes.

Katalin Karikó, inventora de la revolucionaria vacuna contra el COVID basada en ARNm. Fuente de la imagen: es.wikipedia.org
Nuevas vacunas, en tiempo récord
Siguiendo con grandes logros de mujeres en la biotecnología, no podemos dejar de hablar acerca de la científica Sarah Gilbert, quien contribuyó en gran medida al control de la pandemia provocada por COVID19 al crear una de las vacunas contra esta enfermedad. Nos referimos a la vacuna Oxford-Astrazeneca. Sarah Gilbert nació en Northamptonshire, Inglaterra en 1962; estudió biología en la Universidad East Anglia para después obtener el doctorado en genética y bioquímica en la Universidad de Hull. Gilbert es una apasionada en el estudio de los virus y actualmente es una reconocida viróloga de la Universidad de Oxford, en Inglaterra. Sus estudios se han enfocado principalmente en los mecanismos genéticos de enfermedades virales y la producción de vacunas contra virus como la influenza, el ébola, MERS y la malaria. Es una científica que no sólo ha destacado en la academia, sino que incursionó en el campo empresarial cuando cofundó la compañía Vaccitech, que es uno de los centros de investigación para la producción de vacunas más importantes en el mundo. Gilbert, al enterarse que una infección por un nuevo coronavirus amenazaba a la población mundial, comenzó a inicios del 2020, junto con su equipo de trabajo, una serie de investigaciones para crear una vacuna que nos protegiera de cursar una enfermedad grave. Gracias a estudios previos de tecnologías para el desarrollo de vacunas en el laboratorio de Gilbert, ella y su equipo lograron crear en un tiempo récord una vacuna contra el virus del SARS-CoV2. Esta vacuna está basada en la introducción de un fragmento de ADN que codifica para esa misma proteína del virus muy visible de la que hablábamos en la sección anterior, (la proteína espiga). Nuestro cuerpo, al recibir este fragmento de ADN, comienza a tratarlo como cualquier otro gen: lo transcribe a ARNm (sí, ese mismo de la vacuna de Pfizer) y luego lo traduce a la proteína (o un fragmento) correspondiente, la cual despierta la respuesta del sistema inmune ayudando a que se produzcan anticuerpos, que finalmente acabarán protegiéndonos cuando el virus entre de verdad a nuestro cuerpo. Cabe mencionar que la vacuna desarrollada por Gilbert ha sido la más utilizada a nivel mundial, ya que se ha administrado en 183 países en el mundo. Además de los reconocimientos que ha recibido por su contribución al progreso de la ciencia y el bienestar humano, como el Premio Princesa de Asturias de Investigación Científica y Técnica 2021, debe ser inmensamente satisfactorio para cualquier científico que la gente de a pie te agradezca tus logros. En verano de junio del 2021 recibió una ovación de pie de más de un minuto, por parte de los aficionados presentes en el famoso torneo de tenis de Wimbledon.

Sarah Gilbert, co-inventora de la vacuna contra el COVID desarrollada por Astra Zeneca. Fuente de la imagen: es.wikipedia.org
Evolución acelerada en un tubo de ensayo: el que se adapta sobrevive
Frances Arnold, una científica estadounidense que ganó el Premio Nobel de Química en el 2018, es una mujer apasionada por el mundo de las proteínas. Frances Arnold nació en Pittsburgh, Estados Unidos en 1956; estudió la carrera de Ingeniería Mecánica y Aeroespacial en la Universidad de Princeton en Estados Unidos y posteriormente realizó un doctorado en Ingeniería Química en la Universidad de Berkeley. Cuando tenía 30 años, ingresó al Instituto Tecnológico de California donde llevó a cabo estudios sobre las enzimas, que como ya mencionamos son proteínas que aceleran reacciones químicas. La idea de Arnold consistió en manipular las propiedades de las enzimas inspirada en un proceso natural del que todos hemos escuchado: la evolución. Frances demostró que se puede realizar evolución de proteínas en un tubo de ensayo, entendiendo evolución como la adaptación de las especies a un ambiente específico. Arnold demostró que al introducir cambios en la secuencia de aminoácidos de las proteínas (es decir, introducir mutaciones a nivel genético) se puede seleccionar aquellas variantes (nuevas enzimas) que muestran propiedades específicas, por ejemplo, estabilidad a altas temperaturas, capacidad de catalizar nuevas reacciones químicas, o la propiedad de ser activas en medios no “naturales”, por ejemplo, solventes orgánicos. Esta técnica es conocida como evolución dirigida de proteínas. La ingeniosa técnica desarrollada por esta científica es muy utilizada en la actualidad para realizar el diseño de enzimas optimizadas para una aplicación concreta. Por ejemplo, realizando evolución dirigida de enzimas como las celulasas, se han obtenido versiones mejoradas que pueden descomponer materia prima compleja (residuos agroindustriales o material vegetal rico en celulosa) en materia prima más simple (azúcares simples), que puede ser utilizada para cultivar microorganismos; microorganismos que a su vez también pueden ser mejorados, como la bacteria con enzimas mejoradas que es capaz de producir isobutanol, un compuesto que puede ser utilizado como combustible. Frances no solo es una científica de gran nivel, sino que también se ha interesado porque sus descubrimientos impacten positivamente a la sociedad; es co-fundadora de empresas como Gevo Inc. y Provivi Inc. que se dedican a producir combustibles a partir de materia prima renovable, y pesticidas de bajo impacto ambiental, respectivamente. Es interesante mencionar que Arnold comenzó a desarrollar esta idea en la década de 1990, y finalmente le valió para obtener el Premio Nobel casi… ¡30 años después! Actualmente Frances Arnold es profesora de Ingeniería Química, Bioingeniería y Bioquímica del Instituto Tecnológico de California, donde instruye nuevos científicos y sigue innovando en el mundo de la ingeniería de proteínas.

Frances Arnold obtuvo el Premio Nobel en Química en 2018 por el desarrollo de la evolución dirigida de proteínas, que permite obtener proteínas mejoradas. Fuente de la imagen: en.wikipedia.org

Emanuelle Charpentier (izquierda) y Jennifer Doudna (derecha) obtuvieron el Premio Nobel en Química en 2020 por sus descubrimientos del sistema CRISPR-Cas9 para la edición genética. Fuente de la imagen es.wikipedia.org
Edición de errores en el genoma: la más avanzada de las biotecnologías a la fecha
Dos biotecnólogas cuyos avances serán imprescindibles para el avance de la biotecnología moderna son Jennifer Doudna y Emanuelle Charpentier. Estas dos científicas obtuvieron el Premio Nobel en Química en 2020 por sus investigaciones referentes a la edición del ADN. Jennifer Doudna nació en Washington, Estados Unidos en 1964; estudió Química en la Universidad de Pomona y el Doctorado en Bioquímica en la Universidad de Harvard. Actualmente es profesora de bioquímica y biología molecular en la Universidad de California en Berkeley. Desde sus inicios en la vida científica, Doudna estuvo interesada en estudiar los ácidos nucleicos: los bloques que forman el ADN y el ARN, éste último es aquél que participa en la síntesis de proteínas en las células que forman nuestro cuerpo, como ya se explicó en la historia de Katalin Karikó y la vacuna basada en ARNm (la de Pfizer). Específicamente, esta científica centra su investigación en el estudio del ARN y los procesos moleculares y biológicos en los que participa, lo cual tiene aplicaciones en el área de la medicina. Por otro lado, Emanuelle Charpentier nació en Francia en el año de 1968; estudió Bioquímica en la Universidad Pierre y Marie Curie en París, posteriormente obtuvo el Doctorado en Microbiología por el Instituto Pasteur, en donde estudió la resistencia a antibióticos a partir de estudios del ADN de bacterias. Actualmente trabaja como investigadora del Instituto Max Planck en Berlín, donde dirige la unidad sobre ciencia de patógenos y lleva a cabo su investigación del mecanismo de enfermedades causadas por bacterias. Fue en el año 2011 cuando ambas científicas comenzaron una colaboración para conjuntar los conocimientos que ambas habían desarrollado. Estas científicas lograron aplicar una novedosa tecnología, denominada CRISPR-Cas9, para la edición del ADN; de manera general incluye una molécula de ARN guía (CRISPR) y una enzima (Cas9) que corta el ADN. Los aportes de estas científicas han permitido a la ingeniería genómica modificar el código de la vida; es decir, editar el ADN de una manera más eficiente y simple de cómo se realizaba anteriormente en los laboratorios. La tecnología CRISPR-Cas9 ha sido un avance revolucionario para la biotecnología y la biomedicina, específicamente en las terapias génicas, ya que permite “corregir” errores o “eliminar” defectos en la secuencia de ADN, ya que aquellas secciones que corresponden a genes, pero también las que sirven para regular la expresión de dichos genes. Su potencial se describe a mayor detalle en una entrega anterior (ver lecturas recomendadas).
Como ilustramos en esta contribución, existen muchas mujeres científicas y biotecnólogas con talento y que han hecho descubrimientos y avances muy relevantes en su campo. Esperamos con estas historias de éxito despertar y estimular la vocación y curiosidad científica en jóvenes, sobre todo en mujeres. En México necesitamos que más gente se involucre en la ciencia, no sólo en su construcción, sino también en su difusión, divulgación, enseñanza. Una sociedad educada es una sociedad más próspera, en todo sentido.
Lecturas recomendadas
Para conocer más sobre el tema de mujeres biotecnólogas y bioquímicas en la ciencia, así como contribuciones de la biotecnología al bienestar de la gente y cuidado del medio ambiente, pueden consultar las siguientes lecturas.
1.- Marcela Ayala, Agustín López-Munguía. “Sobre proteínas, bioterapeúticos y biotecnología”. La Unión de Morelos. 28 de diciembre, 2015. http://acmor.org/articulos-anteriores/sobre-prote-nas-bioterap-uticos-y-biotecnolog-a
2.- Agustín López-Munguía. “La Biotecnología: breve historia de un sistema complejo” Biotecnología en Movimiento, revista de divulgación del Instituto de Biotecnología, UNAM. 23 (2020) 24-31. https://biotecmov.files.wordpress.com/2020/09/btmv23-06_biotecsistcmpx-lopeza.pdf
3.- Marcela Ayala, Mayra Avelar. “Contribuciones de científicas en el área de la bioquímica: desentrañando los secretos de las células”. Quimiofilia, divulgación de la ciencia química. 25 (2022) 28-35. https://quimiofilia.com
4.- Georgina Hernández. “Covid-19 avances y perspectivas”. La Unión de Morelos. 11 de mayo, 2020. http://acmor.org/publicaciones/covid-19-avances-y-perspectivas
5.-Fidel Alejandro Sánchez. “La carrera hacia la vacuna contra COVID-19” (primera parte). La Unión de Morelos. 7 de septiembre, 2020. http://acmor.org/publicaciones/la-carrera-hacia-la-vacuna-contra-covid-19-primera-parte
6.-Fidel Alejandro Sánchez. “La carrera hacia la vacuna contra COVID-19” (segunda parte). La Unión de Morelos. 14 de septiembre, 2020. http://acmor.org/publicaciones/la-carrera-hacia-la-vacuna-contra-covid-19-segunda-parte
7.-Fidel Alejandro Sánchez. “Premio Nobel de Química 2020: herramientas para la edición genómica”. La Unión de Morelos. 19 de octubre, 2020. http://acmor.org/publicaciones/premio-nobel-de-qu-mica-2020-herramientas-para-la-edici-n-gen-mica
8.-Elie Dolgin. “The tangled history of mRNA vaccines”. Nature 597, 318-324 (2021). https://www.nature.com/articles/d41586-021-02483-w
Esta columna se prepara y edita semana con semana, en conjunto con investigadores morelenses convencidos del valor del conocimiento científico para el desarrollo social y económico de Morelos. Desde la Academia de Ciencias de Morelos externamos nuestra preocupación por el vacío que genera la extinción de la Secretaría de Innovación, Ciencia y Tecnología dentro del ecosistema de innovación estatal que se debilita sin la participación del Gobierno del Estado.



