Un estimado colega nos comparte hoy el presente artículo, publicado el 26 de septiembre de 2024 en la sección de noticias de la página Web de Stowers Institute for Medical Research y traducido por nosotros para este espacio. Veamos de que se trata…
Las lesiones espontáneas, como la pérdida de una extremidad o un daño en la médula espinal, son imposibles de reparar para los humanos. Sin embargo, algunos animales tienen una capacidad extraordinaria para regenerarse después de una lesión, una respuesta que requiere una secuencia precisa de eventos celulares. Una nueva investigación del Stowers Institute for Medical Research ha revelado un factor crítico de tiempo (específicamente, cuánto tiempo tardan las células en responder activamente a una lesión) involucrado en la regulación de la regeneración.
Un estudio reciente publicado en iScience el 20 de septiembre de 2024, buscó comprender exactamente cómo un organismo sabe cuánto tejido se ha perdido después de una lesión.


Dirigido por investigador Dr. Augusto Ortega Granillo, en el laboratorio del presidente y director científico de Stowers, Dr. Alejandro Sánchez Alvarado, el equipo investigó cómo los peces killi africanos regeneran adecuadamente su aleta caudal después de un daño.
Al analizar la dinámica de los tejidos durante el recrecimiento, descubrieron que, además de factores conocidos, como cuántas células participan y dónde se encuentran, el tiempo que las células pasan involucradas en el proceso de reparación también es clave.
"Uno de los mayores misterios sin resolver de la regeneración es cómo sabe un organismo lo que se ha perdido después de una lesión", dijo Sánchez Alvarado. "Básicamente, el estudio apunta a una nueva variable en la ecuación de la regeneración. Si podemos modular la velocidad y la duración del tiempo que un tejido puede iniciar una respuesta regenerativa, esto podría ayudarnos a diseñar terapias que puedan activar y tal vez prolongar la respuesta regenerativa de tejidos que normalmente no lo harían".
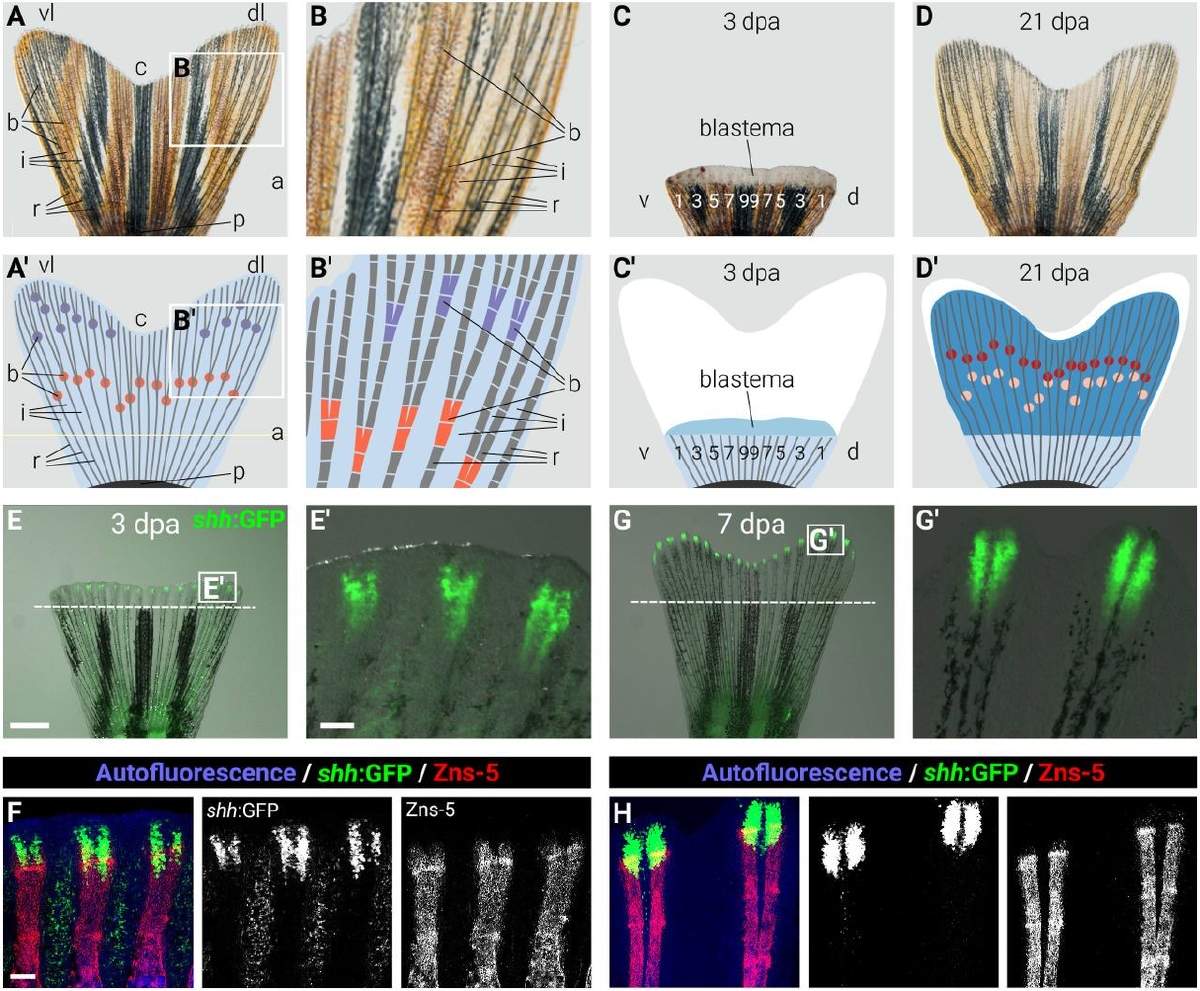
Poco después de una lesión en la cola de un pez killi, el tejido restante necesita saber cuánto daño se ha producido. Luego, este tejido debe reclutar la cantidad adecuada de células reparadoras en el lugar de la lesión durante la cantidad de tiempo adecuada. La detección del daño, el reclutamiento de células reparadoras y el momento oportuno deben trabajar juntos de alguna manera para que la cola vuelva a crecer.
"Si un animal que puede regenerar extremidades, como la cola, pierde sólo una pequeña parte, ¿cómo sabe que no debe regenerar una cola nueva entera, sino sólo la parte que falta?", se pregunta Sánchez Alvarado. Para abordar esta cuestión, el equipo investigó diferentes lugares de la aleta caudal del pez killi con lesiones.
Descubrieron que las células de la piel, tanto las cercanas a la lesión como las de las regiones distantes no lesionadas, ponen en marcha un programa genético que prepara a todo el animal para una respuesta de reparación. A continuación, las células de la piel en el lugar de la lesión mantienen esta respuesta y cambian temporalmente su estado para modificar el material circundante, llamado matriz extracelular.
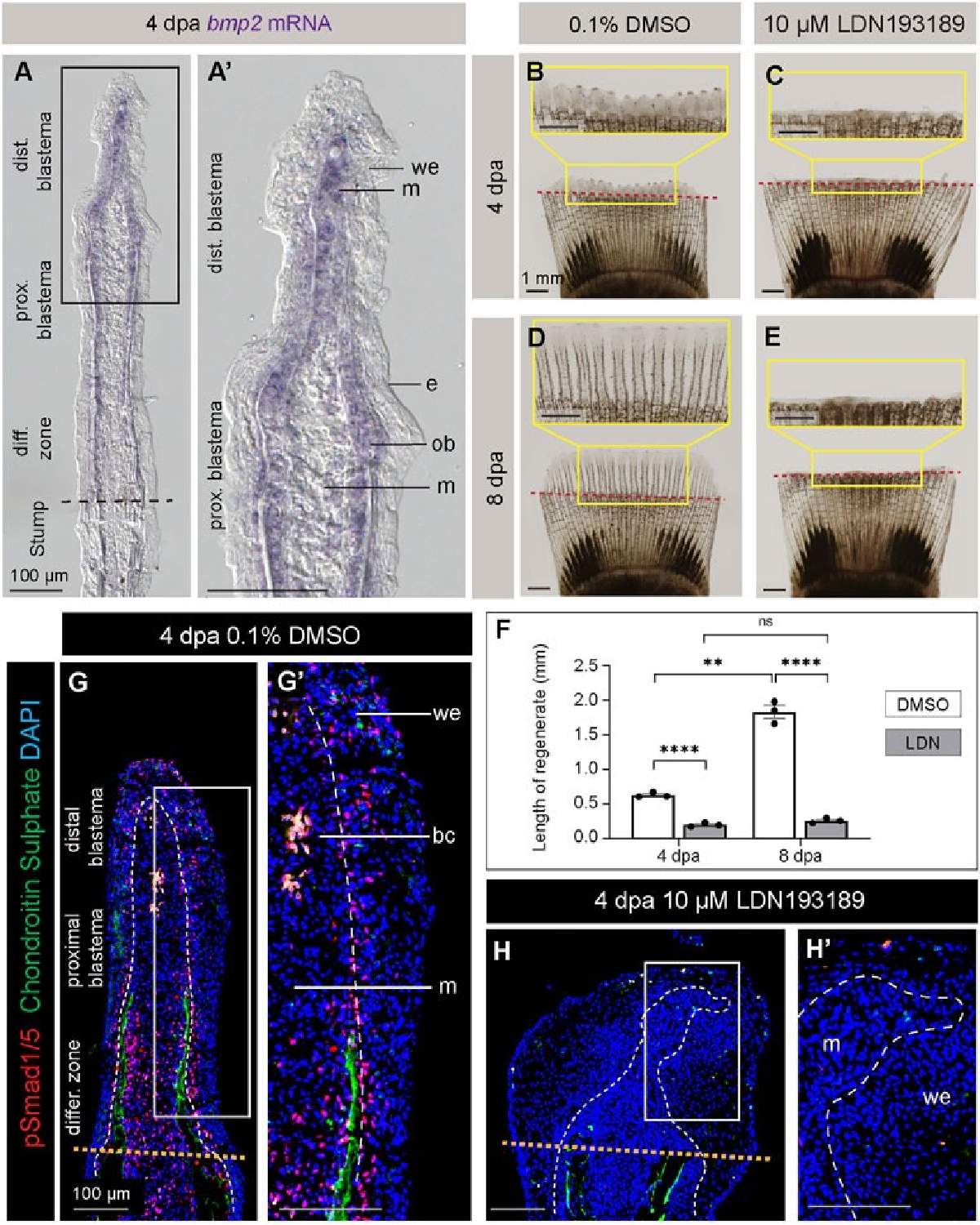
Ortega Granillo compara esta matriz con una esponja que absorbe las señales secretadas por el tejido lesionado y que luego guía a las células reparadoras para que se pongan a trabajar. Si las señales no se reciben o no se interpretan correctamente, el proceso de regeneración puede no restaurar la forma y el tamaño originales de la cola.
"Definimos muy claramente cuándo y dónde (a las 24 horas posteriores a la lesión y en la matriz extracelular) actúa el estado celular transitorio en el tejido de la aleta", dijo Ortega Granillo. "Saber cuándo y dónde buscar nos permitió realizar alteraciones genéticas y comprender mejor la función de estos estados celulares durante la regeneración".
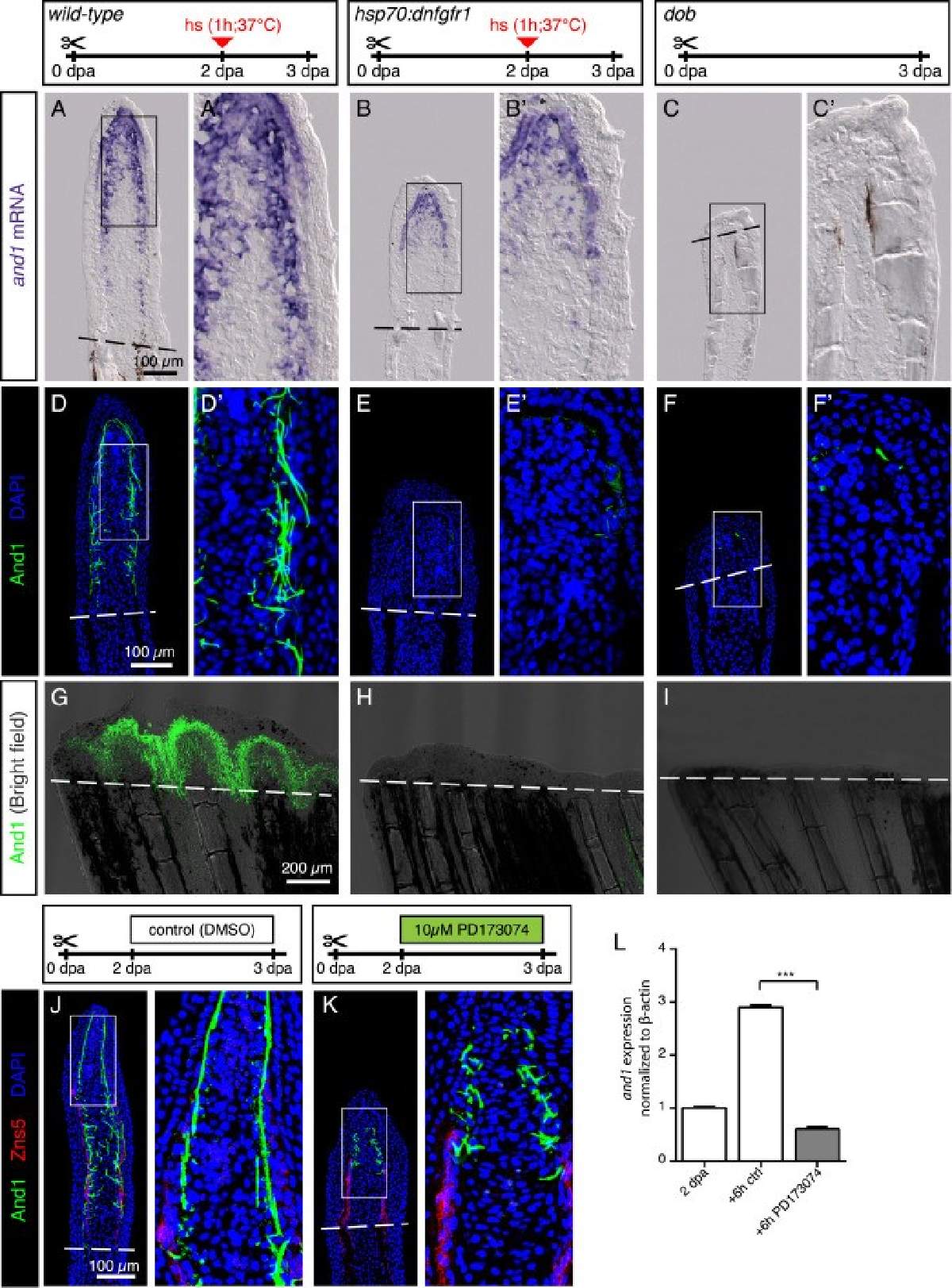
Para investigar si estos estados celulares distintos comunican información a la matriz extracelular (la estructura de soporte que rodea a las células) durante el proceso de reparación, los investigadores emplearon la técnica de edición genética CRISPR-Cas9. Se enfocaron específicamente en un gen conocido por modificar la matriz extracelular, ya que habían observado su activación al inicio de la respuesta de regeneración.
Al alterar la función de este gen, el equipo pretendía determinar su papel en la transmisión de información de las células a la matriz durante la regeneración.
"Estos animales modificados ya no saben cuánto tejido se perdió", dijo Ortega Granillo. "Aún se regeneraban, pero la velocidad de crecimiento del tejido era deficiente. Esto nos dice que al cambiar el espacio extracelular, las células de la piel informan al tejido cuánto se perdió y cuán rápido debe crecer".
De hecho, la velocidad y la cantidad de tejido regenerado en estos killis genéticamente modificados aumentaron independientemente de si la lesión en la cola era leve o grave. Este hallazgo abre la posibilidad de que los estados celulares que modifican la matriz aumenten el recrecimiento regenerativo. Si los estados celulares pudieran ajustarse, podría ser una forma de estimular una respuesta de regeneración más robusta.
Desde una perspectiva evolutiva, comprender por qué ciertos organismos sobresalen en la regeneración mientras que otros, como los humanos, tienen capacidades regenerativas limitadas es una fuerza impulsora en el campo de la biología regenerativa. Al identificar principios generales en organismos con alta capacidad regenerativa, los investigadores pretenden aplicar potencialmente estos conocimientos para mejorar la regeneración en humanos.
Este enfoque comparativo no solo arroja luz sobre los aspectos evolutivos de la regeneración, sino que también es prometedor para el desarrollo de nuevas estrategias terapéuticas en medicina regenerativa.
"Nuestro objetivo es comprender cómo se forman y se desarrollan los tejidos", afirmó Ortega Granillo. "En el caso de las personas que sufren lesiones o insuficiencia orgánica, las terapias regenerativas podrían restaurar la función que se vio comprometida durante una enfermedad o después de una lesión".
Entre los autores adicionales se encuentran Daniel Zamora, Robert Schnittker, Allison Scott, Alessia Spluga, Jonathon Russell, Carolyn Brewster, Eric Ross, Daniel Acheampong, Ning Zhang, Ph.D., Kevin Ferro, Ph.D., Jason Morrison, Boris Rubinstein, Ph.D., Anoja Perera y Wei Wang, Ph.D.




