Crédito: Víctor Barba López, Elizabeth América Flores Frías, Edna Vázquez Vélez y Horacio Martínez Valencia
Víctor Barba López, es Profesor-Investigador Titular C y actual director del Centro de Investigaciones Químicas-Universidad Autónoma del Estado de Morelos (UAEMor). Es miembro del Sistema Nacional de Investigadores nivel III. Sus principales líneas de Investigación son: “Estudio de la reactividad de ácidos borónicos y análisis de sus propiedades fotofísicas” y “Sensores moleculares basados en derivados de boro y estaño”. Es miembro de la Academia de Ciencias de Morelos.
Elizabeth América Flores Frías es Ingeniera Química egresada de la FCQeI de la UAEMor. Posteriormente, obtuvo la Maestría y Doctorado en Ingeniera y Ciencias Aplicadas en la UAEMor. Actualmente, se encuentra haciendo su posdoctorado en el Instituto de Ciencias Físicas de Universidad Nacional Autónoma de México UNAM desarrollando síntesis de inhibidores de corrosión mediante plasma.
Edna Vázquez Vélez estudió la licenciatura, maestría y doctorado en Química en la Facultad de Ciencias Químicas de la Benemérita Universidad Autónoma de Puebla. Realizó un postdoctorado en el Centro Nacional de la Investigación Científica en Yves Sur-Yvette, Francia y actualmente trabaja en el Laboratorio de Espectroscopía del Instituto de Ciencias Físicas de la UNAM.
Horacio Martínez Valencia estudió la licenciatura, maestría y doctorado en Física en la Facultad de Ciencias de la Universidad Nacional Autónoma de México UNAM. Actualmente, es Investigador Titular “C” del Instituto de Ciencias Físicas de la UNAM y es miembro de la Academia de Ciencias de Morelos.
Esta publicación fue revisada por el comité editorial de la Academia de Ciencias de Morelos.
Nada en la naturaleza es fortuito, todo se rige por el equilibrio
En la naturaleza podemos observar distintos tipos de sustancias que conforman al ser humano y su ambiente, realizando funciones indispensables para la vida diaria. Una de estas sustancias son los “quelatos”. ¿Pero de donde viene está extraña palabra? La palabra quelato o quelante viene del griego chēlē, que significa pinza o garra. En nuestro organismo, existen sustancias quelantes que ayudan a la absorción de nutrientes indispensables, aunado a que también pueden evitar el envenenamiento por metales pesados. En la agricultura, los quelantes son utilizados como fertilizantes para llevar todos los nutrientes (hierro, manganeso, zinc, cobre, etc.) hacia toda la planta conservando la fertilidad del suelo.
Adentrándonos más en el campo de la química, a un quelante se le nombra “ligante” porque se enlaza a un metal. Imaginémonos un vaso de agua que contiene una sal de cobre disuelta, donde el metal cobre (Cu+2) se encuentra rodeado por moléculas de agua como en la Figura 1; si agregamos un ligante, su función será desplazar esas moléculas de agua y enlazarse al cobre, para así formar una estructura compleja llamada “quelato” [1]. En la misma figura observamos el ligante llamado etilendiamina, que es una molécula orgánica donde cada átomo de Nitrógeno (N) dona un par de electrones al metal (Cu+2) o centro metálico para formar un enlace o un sitio de unión (marcado en línea roja). Si la molécula orgánica posee más de un átomo donador de electrones se formarán más sitios de unión, así un quelato con dos sitios de unión se llamará bidentado, si son tres tridentado, cuatro tetradentado y así sucesivamente. Si el ligante tiene muchos átomos capaces de enlazar al metal, se nombrará polidentado. En química al quelato unido al metal se le nombra “complejo de coordinación” [2]. Entre más sitios de unión tenga el complejo, será más estable. Por esta razón, se dice que los quelatos son el perfecto equilibrio ya que son productos de alta estabilidad capaces de mantener los iones metálicos rodeados de una molécula orgánica que los protege de su entorno.
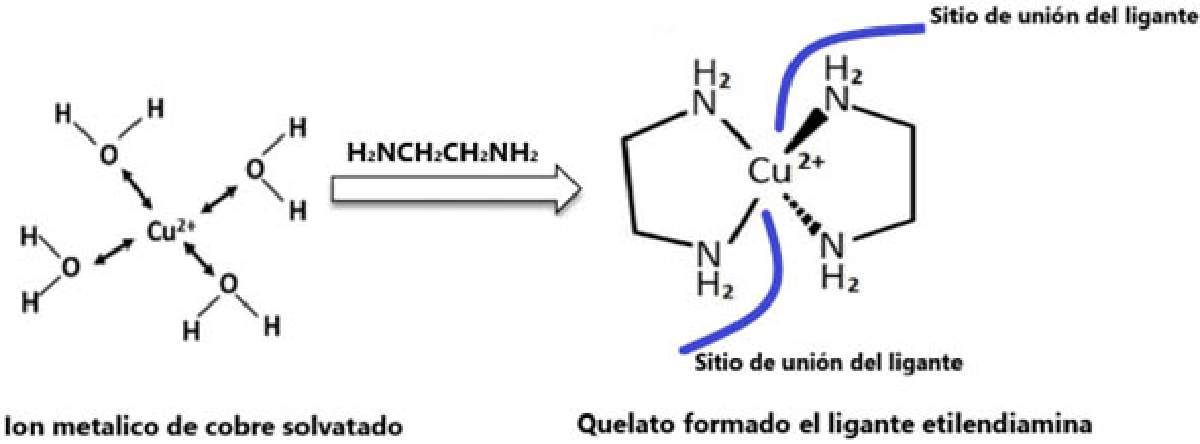
Figura 1. Formación del quelato. https://hive.blog/hive-196387/@emiliomoron/solvatacion
Algunas funciones de los quelatos
El hierro es uno de los nutrientes más importantes tanto para las plantas como para los animales, pero tiene el inconveniente de formar compuestos insolubles de difícil absorción. Por ejemplo, cuando el hierro se dispersa como fertilizante en forma de la sal sulfato de hierro (Figura 2), el metal que entra en contacto con el oxígeno del aire y un medio de agua neutra tenderá a oxidarse y precipitar como hidróxido férrico (Fe (OH)3), que es extremadamente insoluble. Sin embargo, el mismo hierro en forma de quelato se mantiene soluble y es absorbido fácilmente por las raíces [3]. Por lo que la importancia de los quelantes se debe a su capacidad de incrementar la solubilidad de los cationes metálicos y por consecuencia su movilidad, tanto por difusión como por movimiento de masa aumentando así la disponibilidad del metal para las raíces de las plantas [5]. Una vez que el quelante cedió el hierro a la planta, entra nuevamente al ciclo para solubilizar más hierro [4].
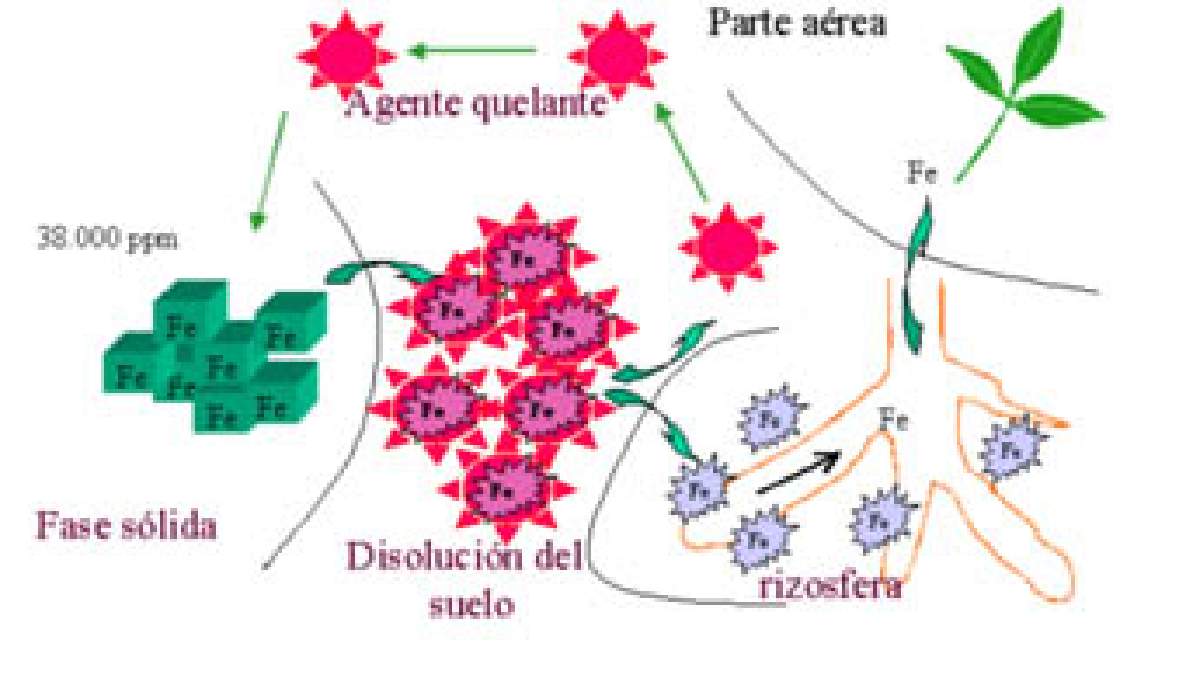
Figura 2. Ciclo del quelato.
http://www.abcagro.com/fertilizantes/quelatos.asp
El cuerpo humano
Ahora bien ¿cómo funcionan los quelatos en el cuerpo humano? El magnesio y el potasio son algunos de los tantos minerales esenciales para el ser humano. Al igual que el hierro, estos metales deben ser quelados para su óptima absorción porque de esta manera se evita que los centros metálicos interactúen con otros compuestos. Normalmente un gran porcentaje de la ingesta diaria de alimentos contiene químicos que inhiben la absorción del magnesio, potasio y demás minerales, y es aquí donde radica la importancia de consumir minerales quelados para asegurar la absorción de estos [6]. Los minerales pueden ser quelados con aminoácidos, de esta manera el organismo aprovecha los beneficios de ambos, por ejemplo, el magnesio lo podemos encontrar quelado con el aminoácido glicina para así formar el glicinato de magnesio.
Los metales pesados como el arsénico, mercurio, cadmio y plomo se van acumulando a través de la ingesta de alimentos, agua y aire contaminado, para su eliminación del cuerpo es necesario utilizar moléculas (ligantes) que sean capaces de unirse a ellos y permitan eliminarlos formando compuestos estables y de alta solubilidad. Los ligantes más utilizados por los médicos para la eliminación de metales pesados son: ácido etilendiaminotetraacético (EDTA), Dimercaprol (BAL) y ácido dimercaptosuccinico (DMSA) [7], los cuales se muestran en la Figura 3. Sin embargo, no solo podemos utilizar este tipo de ligantes artificiales para eliminar los metales pesados, existen quelantes que podemos obtener de la naturaleza, también mostrados en la Figura 3. La curcumina es un quelante muy utilizado como especie en la comida, al igual que el ácido fítico procedente de semillas, y también la alicina y aliina presentes en el ajo. Todos estos quelantes naturales al igual que el EDTA pueden utilizarse para quelar metales pesados.
El ácido cítrico es un quelante natural obtenido a partir del limón o la naranja que en su estructura química tiene cuatro átomos que pueden unirse a un metal en forma de anillo, para obtener quelatos estables, asimilables y fitocompatibles con la mayoría de los cationes metálicos. Por esta razón, el ácido cítrico ha sido usado para la quelación efectiva de magnesio, calcio, zinc, manganeso, hierro, cobre, molibdeno, cobalto y otros metales.
La ventaja de los quelantes naturales es su biodegradabilidad, que los quelantes sintéticos no tienen y además puede resultar ser igual de efectivo al movilizar la mayor cantidad de metales pesados del suelo hacia la planta. En este sentido sería de gran interés estudiar más quelantes naturales en la absorción de metales pesados.
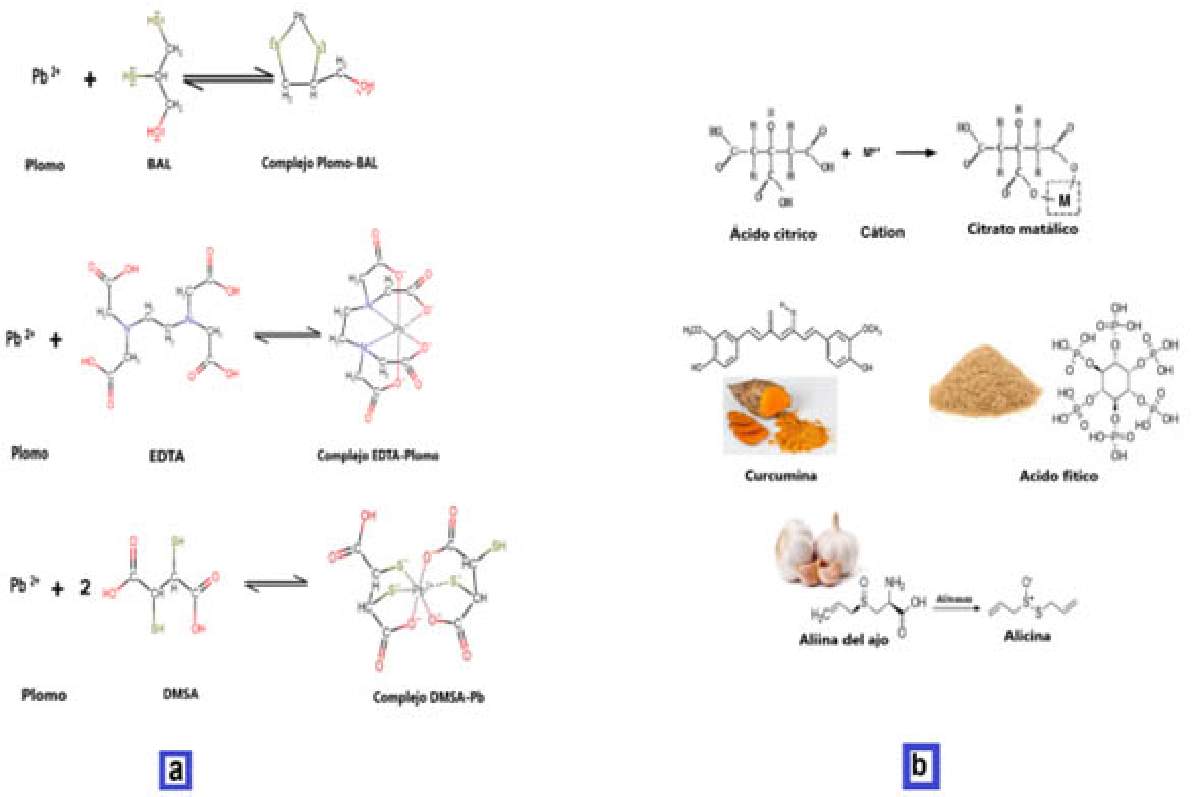
Figura 3. Diferentes tipos de quelantes para la formación de quelatos.
Los ácidos orgánicos más efectivos en formar quelatos complejos estables con los iones metálicos son aquellos del tipo del ácido cítrico (por su estructura química: Hidroxi-Tricarboxílicos) tales como el Acido Málico, Tartárico, Glucónico y Láctico; ellos han demostrado ser responsables de mantener el hierro soluble adentro de las plantas. Además, en la quelación del cobre, el ácido Cítrico tiene ventajas sobre el quelante sintético EDTA en suelos altos en calcio y magnesio debido a su inferior afinidad por estos nutrientes.
Aplicaciones de los quelatos
Tanto el ácido cítrico, como una amplia variedad de otros ácidos orgánicos, han sido identificados en los exudados de las raíces de los vegetales comunes, cereales y soya. Por ejemplo, el cacao es un producto alimenticio que ha tenido un crecimiento bastante marcado en los países productores debido a su fácil manejo y los excelentes beneficios económicos que presenta; sin embargo, sus regulaciones en cuanto al contenido de plomo o cadmio con una cantidad mayor o igual al 50% de sólidos de cacao debe contener un máximo de 0,3 mg/kg de cadmio y 1 mg/kg de plomo (CODEX Alimentarius, 2015). El uso de quelantes en la agricultura reduce el riesgo de la acumulación de metales pesados en frutos, semillas o plantas maximizando al mismo tiempo la asimilación de nutrientes.
Conclusiones
Como hemos leído anteriormente, los quelantes son importantes para la agricultura y la salud de la humanidad. Por ello mismo es importante seguir investigando quelantes naturales que resulten igual de efectivos que los sintéticos para la formación de quelatos y así contribuir a la eliminación de metales pesados, ya que hasta ahora el más utilizado y reconocido es el sintético EDTA.
Referencias.
[4]http://www.abcagro.com/fertilizantes/quelatos.asp
[5]https://www.scielo.org.mx/scielo.php?script=sci_arttext&pid=S2007-07052018000200403
[6]https://www.scielo.cl/scielo.php?pid=S0717-75182018000500381&script=sci_arttext
[8]http://scielo.senescyt.gob.ec/scielo.php?script=sci_arttext&pid=S1390-85962018000100021
Esta columna se prepara y edita semana con semana, en conjunto con investigadores morelenses convencidos del valor del conocimiento científico para el desarrollo social y económico de Morelos. Desde la Academia de Ciencias de Morelos externamos nuestra preocupación por el vacío que genera la extinción de la Secretaría de Innovación, Ciencia y Tecnología dentro del ecosistema de innovación estatal que se debilita sin la participación del Gobierno del Estado.