La Dra. Tenorio es doctora en ciencias biomédicas, egresada del Centro de Ciencias Genómicas de la UNAM. Su área de especialización es la genética, con un enfoque en ARN largos no codificantes.
El Dr. Cortez es investigador en el Centro de Ciencias Genómicas de la UNAM. Su laboratorio estudia los mecanismos detrás de la determinación del sexo en vertebrados.
Esta publicación fue revisada por el comité editorial de la Academia de Ciencias de Morelos.
Muchas personas se divierten intentando adivinar el sexo de los futuros bebés mientras están dentro del vientre de las mujeres embarazadas. En general, las predicciones se rigen por estereotipos y creencias populares que no son más exactas que un simple volado. Si la panza de la mujer es redonda seguro es niña. Si la panza es puntiaguda seguro es niño. Si se mueve mucho es niño. Si el bebé no patea seguro es niña, etc. Aunque este tipo de adivinanzas son entretenidas, lo que realmente sucede dentro de las células que están formando ese bebé y que ajustarán, regularán y determinarán su sexo es complejo, fascinante y generalmente desconocido para los futuros futuros padres y madres. En este escrito intentaremos aclarar varios puntos de este proceso y terminaremos relatando nuestros más recientes descubrimientos.
Por más de un siglo, la humanidad se ha preguntado ¿qué hace que un bebé sea niña o niño? La respuesta a esta pregunta se encuentra codificada dentro de nuestras células, formando parte de nuestro material genético. Nuestra piel, cerebro, corazón y todos los demás órganos que tenemos están compuestos por millones de células. Cada una de estas células contiene la información genética necesaria para realizar sus funciones y está resguardada en pequeños elementos a los que llamamos cromosomas. Las células humanas siempre contienen 22 pares idénticos de cromosomas y una pareja extra, que en ciertas personas está formada por dos cromosomas idénticos y en otras personas los cromosomas se ven distintos (Figura 1). A esta “pareja dispareja” la llamamos cromosomas sexuales. Esto es porque generalmente las mujeres son las que tienen los dos cromosomas iguales, a los que llamamos XX, y los hombres tienen dos cromosomas distintos, a los que llamamos XY.
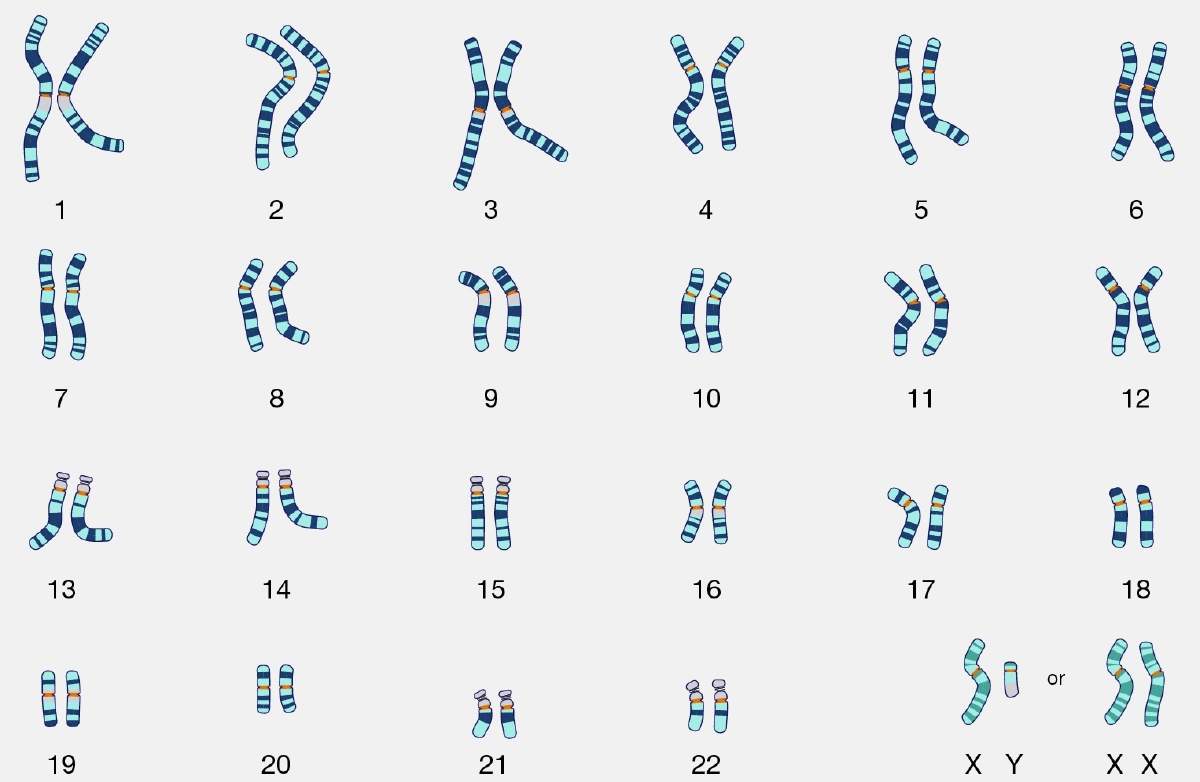
Figura 1. Cariotipo del humano con su pareja de cromosomas sexuales respectiva para mujeres (XX) y para hombres (XY) (imagen obtenida de https://www.genome.gov).
Los bebés heredan un cromosoma sexual del padre y un cromosoma sexual de la madre. El único cromosoma que puede heredar la madre a su bebé es el cromosoma X, en cambio, el padre, puede heredar un cromosoma X o un cromosoma Y. Entonces, si el padre hereda su cromosoma X, el bebé tendrá dos cromosomas sexuales X y el bebé será niña. Si el padre hereda su cromosoma Y, el bebé tendrá los cromosomas sexuales XY y el bebé será niño. Al final, el material genético heredado del padre es lo define el sexo de un bebé. Este panorama general es más o menos lo que la mayoría de la gente conoce sobre este asunto. Sin embargo, los detalles del mecanismo detrás del sexo del bebé son infinitamente más interesantes.
Los cromosomas sexuales en humanos, XY, fueron descubiertos a principios del siglo XX. El hallazgo se atribuye principalmente al trabajo de la genetista estadounidense Nettie Stevens y al embriólogo Edmund Beecher Wilson, quienes, de manera independiente, identificaron estos cromosomas en 1905. Stevens los descubrió trabajando con escarabajos. Observó que los machos y las hembras diferían en el tamaño de un cromosoma, lo que la llevó a proponer que el sexo estaba determinado por estos cromosomas. Wilson, por su parte, confirmó estos hallazgos en humanos estableciendo que los hombres tienen un cromosoma Y que no está presente en las mujeres y que debería de fungir como determinante sexual, es decir, que tuviera la capacidad de canalizar el desarrollo de un embrión hacia el sexo masculino.
Tras estos descubrimientos, a principios del siglo XX, se inicia una vertiginosa carrera científica por descubrir la naturaleza del determinante sexual de los humanos. En 1959 se hace el primer hallazgo importante, estudiando a personas que muestran anomalías en el número de sus cromosomas sexuales. Diferentes grupos de investigación descubren que las personas con síndrome de Turner sólo tienen un cromosoma X (es decir, XO) y son mujeres. Mientras que las personas con síndrome de Klinefelter, con dos cromosomas X y un solo cromosoma Y ( es decir, XXY), son hombres. Estos descubrimientos confirmaron que algo en el cromosoma Y era esencial para que se desarrollaran hombres. En esos momentos, se postula la hipótesis del gen determinante del sexo que debía de estar en algún lugar dentro del famoso cromosoma Y.
Tendrían que pasar muchos años, hasta las décadas de 1980 y 1990, para que los científicos lograran trabajar con regiones específicas del cromosoma Y. En 1987, un equipo liderado por Peter Goodfellow y Robin Lovell-Badge en el Reino Unido delimitó una región sobre el cromosoma Y donde debería de estar el gen determinante del sexo. A esta región la llamaron TDF (Factor Determinante del Testículo, por sus siglas en inglés).
Rápidamente, en 1989, un grupo de trabajo que incluía a David Page y sus colegas del Instituto Whitehead en Cambridge, Estados Unidos, identificaron el gen ZFY (Proteína con Dedo de Zinc del Y, por sus siglas en inglés) en la región TDF. Como descubrieron que ZFY codificaba para una proteína que se pegaba al material genético o ADN, y parecía funcionar en los testículos, no tardaron en postularlo como el gen determinante del sexo. Sin embargo, un año más tarde, investigadores australianos descubrieron que ZFY no estaba presente en el cromosoma Y de los marsupiales (como los canguros), por lo que no podía ser el gen universal responsable de la determinación del sexo en todos los mamíferos.
Finalmente, en 1990, los grupos de trabajo de Goodfellow y Lovell-Badge identificaron un gen muy pequeño en la región TDF que sólo se expresaba durante el desarrollo embrionario. Al nuevo gen lo llamaron SRY (Región determinante del sexo en el Y, por las siglas en inglés). Para confirmar que este era el gen determinante del sexo, los científicos realizaron experimentos en ratones. Insertaron el gen SRY en embriones de ratones genéticamente femeninos (XX), y éstos desarrollaron características masculinas.
De esta manera, ahora sabemos que todos los embriones humanos empiezan a formarse como niñas, a menos que durante la sexta semana del desarrollo el gen SRY se active en las gónadas. SRY genera una proteína que apaga el desarrollo de los ovarios y activa el desarrollo del testículo. Cuando SRY no existe en las células (como en una persona XX) o no se activa correctamente (por alguna variación genética), el embrión se seguirá desarrollando con el programa por default y dará lugar a una niña perfectamente sana.
Dentro de los cromosomas sexuales, el cromosoma X es de mayor tamaño y es el onceavo cromosoma con más genes en nuestro genoma, con un total de 864 genes. El cromosoma Y, por el contrario, es el cromosoma con menos genes en nuestro genoma, con únicamente 63 genes. Cuando en 2001 David Page y sus colegas obtuvieron el atlas completo del cromosoma Y se dieron cuenta de que la mitad de sus genes tenían una copia divergente en el cromosoma X. Estos hallazgos nos dieron información suficiente para imaginarnos cómo se dio el origen de los cromosomas sexuales. El mejor modelo que tenemos propone que hace 180 millones de años, en el ancestro de los mamíferos, los cromosomas XY eran un par de autosomas (cromosomas no sexuales) idénticos. Tras la aparición de SRY, se marcó el inicio de la diferenciación entre los cromosomas sexuales. SRY se originó como una nueva variante de un gen involucrado en el desarrollo de varios órganos, al que conocemos como SOX3 y que está en el cromosoma X. Cuando SRY asume su papel como determinante sexual de los machos decimos que aparece el cromosoma Y. El cromosoma Y dejó de corregir errores y rupturas porque no pudo utilizar la secuencia del cromosoma X a manera de molde para llevar a cabo las reparaciones; utilizar al cromosoma X para corregir problemas en el cromosoma Y podría provocar que SRY fuera reemplazado por SOX3 y volviéramos a la casilla de inicio, cuando aún no teníamos cromosomas sexuales. Como resultado, los cambios y errores se acumularon y paulatinamente la mayoría de los genes en el cromosoma Y se perdieron, reduciendo el tamaño de este cromosoma. A este proceso lo conocemos como la degeneración del cromosoma Y.
Después de la pérdida masiva de genes del cromosoma Y se generó otro problema importante, pues los mamíferos machos se quedaron con un solo cromosoma X activo mientras que las hembras conservaban dos cromosomas X activos. Como cada copia produce un producto, una cierta cantidad de proteína, esto llevaría a que las mujeres tuvieran el doble de los productos del cromosoma X que los hombres. ¿Las diferencias en cantidad de proteína entre sexos provocaría un desastre en las células? ¿Cómo sería posible que los embriones masculinos se desarrollaran completamente si tuvieran solamente la mitad de productos del cromosoma X?
Afortunadamente esto no es así gracias a un mecanismo conocido como compensación de dosis. Para que todos los humanos, tanto los hombres como las mujeres, expresen la misma cantidad de productos del cromosoma X a pesar de sus diferencias en contenido genético, uno de los cromosomas X en las mujeres (elegido al azar) se inactiva, permitiendo que solo un cromosoma X sea funcional. En los hombres no opera este mecanismo. Esto tiene como resultado que hombres y mujeres expresemos la misma cantidad de productos de los genes del cromosoma X. El cromosoma X inactivo representa, en cierto sentido, la ausencia de genes en el cromosoma Y.
La historia sobre la inactivación del cromosoma X inició en 1949, cuando los investigadores Murray Barr y Ewart Bertram descubrieron los corpúsculos de Barr, que son unas estructuras opacas que sólo se lograban observar usando herramientas de microscopía dentro de los núcleos de las células de las hembras y que no estaban presentes en los machos.
En la década de 1950, Susumu Ohno, un destacado genetista y biólogo evolutivo japonés, propuso que el cromosoma Y de los mamíferos había perdido la mayoría de sus genes a lo largo de la evolución y que la dosis génica (el número de copias activas de un gen) se debe de mantener igual entre los dos sexos porque es crítica para la supervivencia de los organismos.
Las ideas de Ohno fueron fundamentales para que en 1961 la genetista británica Mary Lyon propusiera la hipótesis de Lyon. En su hipótesis, Lyon sugirió que en las hembras de los mamíferos, uno de los dos cromosomas X se inactiva al azar durante el desarrollo embrionario temprano. Gracias a este proceso se asegura que las células femeninas sólo produzcan la mitad de las proteínas codificadas por los genes del cromosoma X y se tenga la misma cantidad de productos que en los machos, cumpliendo así con la predicción de Susumu Ohno sobre la dosis génica.
En las décadas siguientes, los científicos buscaron identificar los genes y mecanismos responsables de la inactivación del cromosoma X. Fue en 1991, apenas un año después del descubrimiento de SRY como determinante sexual, cuando un equipo de investigadores encabezado por Carolyn J. Brown y Huntington F. Willard descubrió el gen XIST (Transcrito específico de la inactivación del X, por sus siglas en inglés). XIST se transcribe en un ARN no codificante (es decir, no produce una proteína), pero que juega un papel clave en la inactivación del cromosoma X. Los investigadores observaron que el ARN de XIST se acumulaba sobre del cromosoma X que iba a ser inactivado, formando una especie de "capa" que recubría el cromosoma y desencadenaba su condensación y silenciamiento a través de procesos epigenéticos, lo que significa que no altera la secuencia de ADN, pero sí su expresión.
El ARN de XIST actúa como una molécula reguladora, que recluta proteínas y complejos enzimáticos para modificar la cromatina del cromosoma X. Estas modificaciones incluyen la adición de marcas epigenéticas, como la metilación de histonas y la metilación del ADN, que silencian la expresión génica. Una vez que el cromosoma X es inactivado, el estado de silenciamiento se mantiene de manera estable durante toda la vida de las mujeres. Los fallos en el funcionamiento de XIST pueden producir una mayor cantidad de productos provenientes del cromosoma X y pueden desencadenar enfermedades celulares como el cáncer.
Los humanos y mamíferos no son las únicas especies que tienen cromosomas sexuales. Todas las aves y miles de especies de reptiles, anfibios, peces e insectos también presentan cromosomas sexuales que sirven para definir qué embriones desarrollarán gónadas femeninas o masculinas. En particular, nosotros nos hemos interesado en el grupo más amplio de reptiles. Este grupo mega-diverso incluye a las iguanas, lagartijas y basiliscos. Todas estas especies tienen cromosomas sexuales del tipo XX en hembras y XY en machos. Durante nuestras investigaciones descubrimos que el cromosoma Y está tan degenerado que sólo le quedan siete genes. La pregunta que nos planteamos a continuación es si la compensación de dosis de los cromosomas X era un mecanismo exclusivo de humanos y mamíferos o si podía existir también en otras especies como solución a la degeneración de uno de sus cromosomas sexuales.
El trabajo lo realizamos en colaboración con investigadoras e investigadores mexicanos de la UNAM y del CINVESTAV y se centró en la lagartija verde como modelo de estudio. Esta lagartija, cuyo nombre científico es Anolis carolinensis (Figura 2), habita al norte del país y su distribución se extiende hasta el sureste de los Estados Unidos.

Figura 2. Hembra (izquierda) y macho (derecha) de la lagartija modelo A. carolinensis (fotos obtenidas de White Python y Zooplus Magazine).
Lo primero que descubrimos es que la expresión de los genes en el cromosoma X está perfectamente compensada entre machos y hembras. Echando mano de una variada gama de estrategias experimentales que analizan la epigenética de los cromosomas, observamos que, a diferencia de humanos y mamíferos, en estas lagartijas el único cromosoma X de los machos está sobre-activado y genera el doble de productos, igualando así la cantidad de productos que producen los dos cromosomas X activos de las hembras.
Nuestros primeros intentos por encontrar a los actores responsables del sistema de compensación fueron infructuosos. Fue hasta que decidimos estudiar el genoma dividido en pequeñas zonas y que no tomamos en cuenta la posición de los genes ya conocidos, que descubrimos un nuevo ARN no codificante que sólo se expresa en el cromosoma X de los machos. A este nuevo gen lo llamamos MAYEX (ARN no codificante que amplifica la expresión del cromosoma X en machos, por sus siglas en inglés). MAYEX junto con varias proteínas, remodelan el cromosoma X entero. Se anclan a cada gen y lo sobre-activan para que produzca el doble de proteína. Cada experimento que realizamos mostró que MAYEX era el principal actor detrás de este proceso regulatorio (Figura 3).
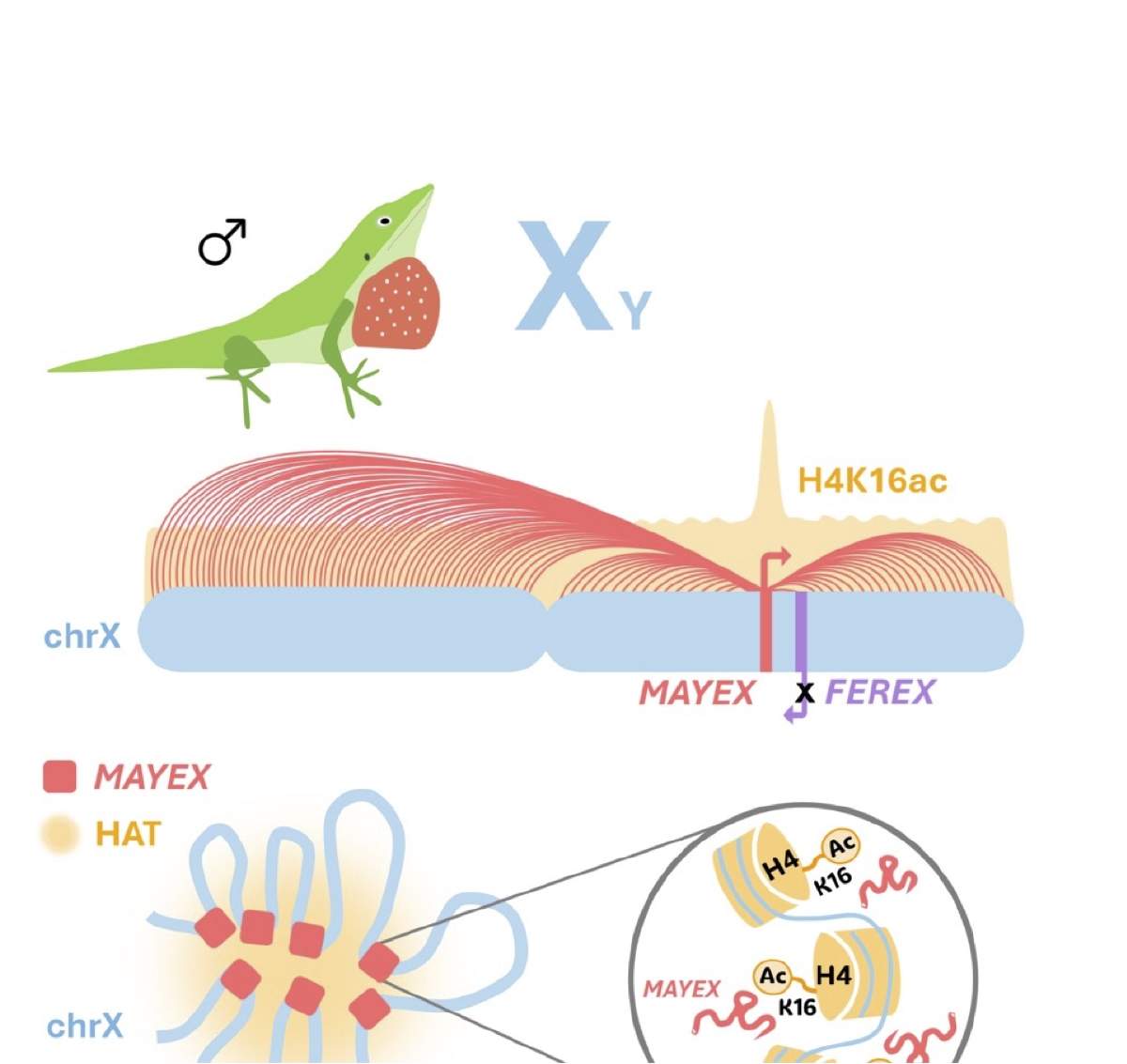
Figura 3. Modelo propuesto de compensación de dosis del cromosoma X en A. carolinensis (figura modificada del artículo científico Tenorio et al., 2024). La imagen muestra a un Anolis macho el cual presenta los cromosomas XY. El cromosoma X está sobreacetilado. MAYEX está manteniendo contacto a lo largo del cromosoma X. Todo el cromosoma X está rodeado por Histonas Acetiltransferasas (HAT), y junto a MAYEX, acetilan las lisinas 16 de las histonas 4 de todo el cromosoma X.
El experimento más importante que hicimos consistió en inhibir la expresión del gen MAYEX, empleando una técnica novedosa llamada CRISPRi. Si nuestro modelo era correcto, al reducir la expresión de MAYEX en los machos, deberíamos de ver una disminución de los productos a lo largo del cromosoma X. Descubrimos que al inhibir al gen MAYEX, los genes aledaños también se empezaron a desactivar, justo como esperábamos. La felicidad nos invadió ese día ya que acabábamos de confirmar, por primera vez en reptiles, la estrecha conexión entre MAYEX y la regulación global del cromosoma X. Además, le pudimos mostrar al mundo que otras especies también pueden tener sistemas alternativos de compensación de dosis de sus cromosomas sexuales y que en reptiles se sigue cumpliendo la predicción que Susumu Ohno postuló hace casi un siglo.
Al buscar nuestro sistema en otros grupos de reptiles, encontramos que MAYEX estaba presente en muchos de ellos. Ahora sabemos que el sistema es muy viejo, de casi 100 millones de años; casi tan viejo como el sistema de compensación que empleamos los humanos. Increíblemente, en humanos y otros mamíferos existe un ARN no codificante en la misma ubicación del genoma en la que estaría MAYEX. En mamíferos el ARN no codificante se llama TUG1 y comparte algunas características con MAYEX. Mientras MAYEX orquesta la compensación de dosis del cromosoma X, TUG1 regula la producción de espermatozoides al modificar la expresión de otros genes que están en el cromosoma X. Es decir, los dos ARN no codificantes que están en esa misma zona del genoma y que divergieron hace 300 millones de años tienen funciones que son esenciales para la sexualidad de los machos.
Cabe resaltar que la compensación de dosis genética de los cromosomas sexuales tiene implicaciones importantes para la biomedicina, particularmente en el estudio de trastornos relacionados con la regulación genética. Algunas afecciones genéticas, como el síndrome de Turner (XO) o el síndrome de Klinefelter (XXY), están directamente relacionadas con desequilibrios en la expresión de los genes de los cromosomas sexuales.
Este campo de estudio también ha mostrado que ciertos trastornos del desarrollo sexual, como la infertilidad y la intersexualidad, pueden estar relacionados con cambios en los mecanismos de compensación de dosis, lo que sugiere que la investigación en este ámbito podría tener un impacto directo en la medicina clínica.
Nuestros hallazgos sobre MAYEX y la regulación de los cromosomas sexuales en reptiles fueron publicados en la prestigiosa revista Science el pasado 19 de septiembre de 2024. Nuestro trabajo es uno de los pocos publicados en esa revista que son 100% mexicanos y que lograron superar un sin fin de barreras y prejuicios inherentes al proceso editorial.
Con este trabajo demostramos que la investigación científica en México está a la misma altura que los centros científicos más avanzados del mundo. La publicación de nuestros resultados en Science no solo es un reconocimiento al esfuerzo que realizamos, sino también un testimonio del potencial de los laboratorios mexicanos para contribuir a la ciencia global.
En un contexto donde cada vez más se valora la internacionalización de la ciencia, este tipo de logros refuerza el prestigio de las instituciones mexicanas y coloca a sus investigadoras e investigadores en una posición de liderazgo en campos tan relevantes como la genética evolutiva.
Esperemos que el apoyo a la ciencia incremente para que se fomente aún más la investigación en áreas críticas, se fortalezcan las colaboraciones internacionales y se desarrollen políticas que faciliten el acceso a recursos y financiamiento. Esto permitirá a los científicos mexicanos seguir explorando preguntas importantes, generando innovaciones y formando a nuevas generaciones de investigadores. A medida que el apoyo a la ciencia crece, también lo hará nuestra capacidad para abordar los desafíos globales y mejorar la calidad de vida de las personas en México y en todo el mundo.
Referencias
Historia sobre la determinación del sexo:
Kubiac, J. Z., Kloc, M. y Piprek, R. P. (2020). History of The Research on Sex Determination. Biomed. J. Sci. Tech. Res. 25. doi: 10.26717/bjstr.2020.25.004194
Stévant, I., Papaioannou, M. D., and Nef, S. (2018). A brief history of sex determination. Mol. Cell. Endocrinol. 468, 3–10. doi: 10.1016/j.mce.2018.04.004
Libro de Susumu Ohno sobre los cromosomas sexuales:
Ohno, S. Sex Chromosomes and Sex-Linked Genes. Springer-Verlag Berlin · Heidelberg 1966. https://link.springer.com/book/10.1007/978-3-642-88178-7
Historia del descubrimiento de la inactivación del cromosoma X en humanos:
Balderman, S., and Lichtman, M. A. (2011). A History of the Discovery of Random X Chromosome Inactivation in the Human Female and its Significance. Rambam Maimonides Med. J. 2, e0058. doi: 10.5041/rmmj.10058
Artículo de Mariela Tenorio del 2024 en Science sobre el mecanismo que opera en lagartijas:
Tenorio, M., Cruz-Ruiz, S., Encarnación-Guevara, S., Hernández, M., Corona-Gomez, J. A., Sheccid-Santiago, F., et al. (2024). MAYEX is an old long noncoding RNA recruited for X chromosome dosage compensation in a reptile. Science 385, 1347–1354. doi: 10.1126/science.adp1932
Esta columna se prepara y edita semana con semana, en conjunto con investigadores morelenses convencidos del valor del conocimiento científico para el desarrollo social y económico de Morelos.




